МПР РОССИИ
ГУПР МПР РОССИИ
ПО ХАНТЫ-МАНСИЙСКОМУ АВТОНОМНОМУ ОКРУГУ
МИНСЕЛЬХОЗ РОССИИ
АССОЦИАЦИЯ
«ГКО РОСРЫБХОЗ»
ФГУП «ГОСРЫБЦЕНТР»
ВРЕМЕННОЕ МЕТОДИЧЕСКОЕ
РУКОВОДСТВО
ПО НОРМИРОВАНИЮ УРОВНЕЙ СОДЕРЖАНИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ
В ДОННЫХ ОТЛОЖЕНИЯХ ПОВЕРХНОСТНЫХ ВОДНЫХ ОБЪЕКТОВ (НА ПРИМЕРЕ НЕФТИ)
РЭФИА, НИА - Природа
Москва - 2002
Настоящее «Временное методическое руководство по нормированию уровней содержания химических веществ в донных отложениях поверхностных водных объектов (на примере нефти)» направлено на установление нормативов допустимого содержания химических веществ, в частности нефти, в донных отложениях поверхностных водных объектов. Документ содержит методы определения максимально допустимых уровней веществ, аккумулированных донными отложениями, на основе результатов модельных экспериментальных исследований с использованием наиболее чувствительных биологических тест-объектов.
Разработанное временное руководство рекомендуется
использовать органами исполнительной власти, осуществляющими управление в сфере
использования и охраны поверхностных водных объектов и водных биологических
ресурсов, охраны окружающей среды при установлении нормативных требований к
качеству вод, допустимой антропогенной нагрузки на водные объекты и водные
экосистемы, проведении работ по оценке воздействия на водные объекты и водные
биологические ресурсы планируемой хозяйственной деятельности, определении
ущерба, наносимого водным биологическим ресурсам в результате загрязнения
поверхностных водных объектов.
ПРЕДИСЛОВИЕ
Настоящий документ «Временное методическое
руководство по нормированию уровней содержания химических веществ в донных
отложениях поверхностных водных объектов» направлен на установление
природоохранных нормативов и содержит методы определения допустимой
концентрации веществ на примере нефти в донных отложениях пресноводных водных
объектов. Документ разработан в соответствии с положениями статей 19, 21
Федерального закона «Об
охране окружающей среды», согласно которых нормативы качества окружающей
среды устанавливаются в целях сохранения естественных экологических систем,
генетического фонда растений, животных и других организмов, и при установлении
которых учитываются природные особенности территорий и акваторий, а также
назначение природных объектов.
Подобный методический документ разрабатывается впервые.
В его основу положены модельные экспериментальные исследования с использованием
биологических тест-объектов. В качестве тест-объектов отобраны донные
организмы: бактерии, укореняющиеся растения, простейшие, черви, моллюски,
ракообразные, личинки насекомых, жизненный цикл которых связан с донными
грунтами. Выбранные организмы являются наиболее чувствительными к действию
токсических веществ, в частности нефти, аккумулированной донными отложениями, и
являются промежуточным звеном в передаче токсических веществ конечному
трофическому звену водной экосистемы - бентосоядным рыбам, потребляющим донные
организмы, и, тем самым, создавая угрозу здоровью человека.
В документе описываются процедуры проведения острых и
хронических опытов при установлении максимально допустимых, пороговых,
сублетальных и летальных концентраций нефти по реакции водных организмов, а
также предельно допустимого уровня нефти (ПДУДО) в донных
отложениях, как нормативного показателя, устанавливаемого по реакции наиболее
чувствительного биологического тест-объекта.
Разработка документа была включена в План подготовки нормативных правовых актов и нормативных документов Министерства природных ресурсов Российской Федерации на 1998 г. В первой редакции проект документа в виде «Методических указаний по установлению нормативов предельно допустимых концентраций химических веществ в донных отложениях поверхностных водных объектов» был рассмотрен и одобрен Секцией нормативно-правового регулирования пользования недрами и водными объектами Научно-технического совета МПР России, и рекомендован к утверждению как «Временное методическое руководство по нормированию уровней содержания химических веществ в донных отложениях поверхностных водных объектов (на примере нефти)» (протокол № 13 от 23 февраля 2000 г, утвержденный председателем Секции, заместителем Министра А.Е. Наталенко). По решению НТС МПР России с целью совершенствования методических подходов было рекомендовано проведение апробации «Руководства» на реках Обского бассейна, подверженных интенсивному нефтяному загрязнению.
В виде «Временного методического руководства по
нормированию уровней содержания химических веществ в донных отложениях
поверхностных водных объектов (на примере нефти)» документ рассмотрен и одобрен
Секцией рыбоводства и рыболовства Научно-технического совета Минсельхоза России
(протокол № 19 от 30 мая 2001г.).
При разработке авторами учтены положения:
«Методических рекомендаций по установлению предельно допустимых концентраций
загрязняющих веществ для воды рыбохозяйственных водоёмов», - М.; ВНИРО, 1986 [2];
«Методических указаний по установлению эколого - рыбохозяйственных нормативов
(ПДК и ОБУВ) загрязняющих веществ для водных объектов, имеющих
рыбохозяйственное значение»; - М.;ВНИРО, 1998; «Методических указаний по
установлению предельно допустимых концентраций вредных веществ для
рыбохозяйственных водоемов и дополнительных характеристик, нужных для расчета
ПДС», - Л.; ГосНИОРХ,1989 [4];
«Руководства по определению методом биотестирования токсичности воды, донных
отложений, загрязняющих веществ и буровых растворов», - М.; РЭФИА, НИА-Природа,
2002 [5].
Разработанный документ рекомендуется применять
органам исполнительной власти, осуществляющим управление в сфере использования
и охраны поверхностных водных объектов и водных биологических ресурсов, охраны
окружающей среды при установлении нормативных требований к качеству вод,
допустимой антропогенной нагрузки на водные объекты и водные экосистемы,
проведении работ по оценке воздействия на водные объекты и водные биологические
ресурсы планируемой хозяйственной деятельности, определении ущерба, наносимого
водным биологическим ресурсам в результате загрязнения водных объектов.
Работа выполнена Федеральным государственным
унитарным предприятием «Сибирским научно-исследовательским и
проектно-конструкторским институтом рыбного хозяйства» (СибрыбНИИпроект)
Минсельхоза России по заказу Государственного комитета по охране окружающей
среды Ханты-Мансийского автономного округа (ныне Главное управление природных
ресурсов и охраны окружающей среды МПР России по Ханты-Мансийскому автономному
округу) и Ассоциации «Государственно-кооперативное объединение рыбного
хозяйства» (Росрыбхоз) Минсельхоза России.
Авторы руководства выражают благодарность за
рецензирование руководства ведущему научному сотруднику биологического
факультета МГУ им. Ломоносова д.б.н. О.Ф. Филенко, заслуженному деятелю науки
Карелии д.б.н. Л.П. Рыжкову, ведущему научному сотруднику ВНИРО д.б.н. С.А.
Патину, заместителю председателя Ихтиологической комиссии д.б.н. С.И.
Никонорову, к.б.н. С.А. Соколовой, главному специалисту мониторинга и охраны
водных объектов МПР России А.С. Гумберту, чьи замечания и предложения были
учтены при подготовке документа.
Разработчики методов:
к.б.н. Л.В.
Михайлова, руководитель работ (заведующая лабораторией экологической
токсикологии СибрыбНИИ проекта, Тюмень);
Т.С.
Князева, И.Ю. Макаренкова, Г.Е. Рыбина, В.И. Уварова (СибрыбНИИпрект,
Тюмень);
Т.Г.
Акатьева, Е.А. Исаченко-Боме (ВНИЦ «Экология», Тюмень),
к.б.н. Г.А. Петухова
(Государственный университет, Тюмень);
к.б.н. А.Н.
Аршаница, к.б.н. Л.А. Лесников,
к.б.н. М.А. Перевозников, к.б.н. И.А. Петрова (Государственный научно-исследовательский
институт озерного рыбного хозяйства, ГосНИОРХ, Санкт-Петербург);
к.б.н. А.Н.
Дзюбан, к.б.н. Д.Б. Косолапов,
к.б.н. И.И. Томилина (Институт
биологии внутренних вод, ИБВВ РАН, п. Борок Ярославской области);
д.б.н., Ю.Г.
Симаков (Государственная технологическая академия, Москва).
Ответственный исполнитель: к.б.н. Л.В. Михайлова
|
МИНИСТЕРСТВО
ПРИРОДНЫХ РЕСУРСОВ РОССИЙСКОЙ ФЕДЕРАЦИИ |
МИНИСТЕРСТВО
СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ |
|
УТВЕРЖДАЮ: Первый заместитель Министраприродных ресурсов Российской Федерации |
УТВЕРЖДАЮ: Заместитель Министра сельского хозяйства Российской федерации |
______________________Н.Н.
Михеев
«___»_________________2001
г. |
______________________Н.К. Долгушкин«___»_________________2001 г |
|
СОГЛАСОВАНО: Председатель Ханты-Мансийского окружающей среды |
СОГЛАСОВАНО: Первый заместитель Председателя Председатель секции рыбоводства и рыболовства |
______________________В. Долингер
«___»_________________2000 г. |
________________________К.П. Мамонтов
«___»___________________2001 г. |
Временное методическое руководство
по нормированию уровней содержания химических
веществ в донных отложениях поверхностных водных
объектов (на примере нефти)
Москва 2001
СОДЕРЖАНИЕ
1.
НОРМАТИВНЫЕ ССЫЛКИ
ГОСТ
7.32-2001 Система стандартов по информации, библиотечному и издательскому
делу. Отчет по научно-исследовательской работе. Структура и правила оформления
ГОСТ
8.211-84 ГСИ Микрометры окулярные винтовые. Методы и средства поверки
ГОСТ 8.423-81
Секундомеры механические. Методы и средства поверки
ГОСТ
12.0.004-90. ССБТ Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91
Пожарная безопасность. Общие требования
ГОСТ
12.4.009-83. ССБТ Пожарная техника для защиты объектов. Основные виды.
Размещение и обслуживание
ГОСТ 12.4.021-75
Системы вентиляционные. Общие требования
ГОСТ
17.1.1.01-77. Использование и охрана вод. Основные термины и определения
ГОСТ
17.1.5.01-80 Гидросфера. Общие требования к отбору проб донных отложений
водных объектов для анализа на загрязненность
ГОСТ 61-75 Кислота уксусная.
Технические условия
ГОСТ
112-78 Термометры метеорологические стеклянные. Технические условия
ГОСТ 166-89 Штангенциркули.
Технические условия
ГОСТ 171-81
Дрожжи хлебопекарные прессованные. Технические условия
ГОСТ
245-76 Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 334-73
Бумага масштабно-координатная. Технические условия
ГОСТ 427-75
Линейки измерительные металлические. Технические условия
ГОСТ 1625-89 Формалин
технический. Технические условия
ГОСТ
1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы,
пробирки. Общие технические условия
ГОСТ
2493-75 Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Кислота
соляная. Технические условия
ГОСТ 4142-77
Кальций азотнокислый 4-водный. Технические условия
ГОСТ
4147-74 Железо (III) хлорид 6-вдный. Технические условия
ГОСТ 4174-77 Цинк
сернокислый 7-водный. Технические условия
ГОСТ
4198-75 Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4209-77 Магний
хлористый 6-водный. Технические условия
ГОСТ 4217-77 Калий
азотнокислый. Технические условия
ГОСТ 4220-75 Калий
двухромовокислый. Технические условия
ГОСТ 4221-76 Калий
углекислый. Технические условия
ГОСТ 4233-77 Натрий
хлористый. Технические условия
ГОСТ 4234-77 Калий
хлористый. Технические условия
ГОСТ 4328-77 Натрия
гидроокись. Технические условия
ГОСТ
4403-91 Ткани для сит из шелковых и синтетических нитей. Общие технические
условия
ГОСТ 4523-77
Магний сернокислый 7-водный. Технические условия
ГОСТ 4616-69 Кальций хлористый двухводный.
Технические условия
ГОСТ 5556-81
Вата медицинская гигроскопическая. Технические условия
ГОСТ 6672-75
Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709-72 Вода
дистиллированная. Технические условия
ГОСТ 6825-91
Лампы люминесцентные трубчатые для общего освещения. Общие технические условия
ГОСТ 9284-75
Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9336-75
Аммонит ванадиевокислый мета. Технические условия
ГОСТ 9412-93 Марля
медицинская. Общие технические условия
ГОСТ 9656-75 Кислота борная.
Технические условия
ГОСТ 10354-82 Пленка
полиэтиленовая. Технические условия
ГОСТ 12026-76
Бумага фильтровальная лабораторная. Технические условия
ГОСТ
13646-68 Термометры стеклянные ртутные для точных измерений. Технические
условия
ГОСТ
13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы
испытания
ГОСТ 14338.3-91. Молибден.
Методы определения фосфора
ГОСТ
14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие
технические условия
ГОСТ
18300-87 Спирт этиловый ректификованный технический. Технические условия
ГОСТ 19179-73 Гидрология
суши. Термины и определения
ГОСТ
19908-90 Тигли, чаши, стаканы, колбы, воронки, пробирки и наконечники из
прозрачного кварцевого стекла. Общие технические условия
ГОСТ
21240-89 Скальпели и ножи медицинские. Общие технические требования и
методы испытаний
ГОСТ
21241-89. Пинцеты медицинские. Общие технические требования и методы
испытаний
ГОСТ 23519-93
Фенол синтетический технический. Технические условия
ГОСТ 24104-2001
Весы лабораторные общего назначения и образцовые. Общие технические условия
ГОСТ
25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные
параметры и размеры
ГОСТ
25706-83 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ
26678-85 Холодильники и морозильники, бытовые электрические компрессионные
параметрического ряда. Общие технические условия
ГОСТ 27065-86 Качество вод.
Термины и определения
ГОСТ
28311-89 Дозаторы медицинские лабораторные. Общие технические требования и
методы испытаний
ГОСТ
29136-91 Мука кормовая из рыбы, морских млекопитающих, ракообразных и
беспозвоночных. Метод определения токсичности
ГОСТ
29227-91 Пипетки градуированные. 4.1. Общие требования
ГОСТ
29251-91 Бюретки. 4.1. Общие требования
СанПиН
2.1.4.559-96 «Питьевая вода. Гигиенические требования к качеству воды
централизованных систем питьевого водоснабжения. Контроль качества»
2. ОСНОВНЫЕ ПОЛОЖЕНИЯ И УСЛОВИЯ РЕГЛАМЕНТАЦИИ ХИМИЧЕСКИХ ВЕЩЕСТВ В ДОННЫХ ОТЛОЖЕНИЯХ (ДО) ПОВЕРХНОСТНЫХ ВОДНЫХ ОБЪЕКТОВ
2.1. Общие положения
2.1.1 Настоящий документ устанавливает процедуру
определения токсичности химических веществ (на примере нефти) в донных
отложениях на уровне максимально допустимых, пороговых, сублетальных и
летальных концентраций для донных организмов (бентос) и бентосоядных рыб, а
также предельно допустимого уровня (ПДУДО) вещества по реакции
наиболее чувствительного биологического тест-объекта или показателя качества
среды обитания.
2.1.2 Предельно допустимый уровень вещества в донных
отложениях (ПДУДО) - это экспериментально определенный и
утвержденный в установленном порядке норматив допустимого содержания в ДО
водного объекта вещества, при котором твердая часть ДО и интерстициальная влага
не отдают его в придонный слой воды в количестве, превышающем ПДК нормируемого
вещества в воде, и не вызывает гибели, нарушения жизнедеятельности, отдаленных
последствий на потомство организмов бентоса и рыб-бентофагов, а также порчи
товарных качеств промысловых гидробионтов при непосредственном контакте их с
загрязненными ДО и через пищевые цепи (ДО-бентос-рыба).
2.1.3 ПДУДО может быть нормативом
федерального или регионального уровня.
2.1.4 ПДУДО рассчитывается на единицу
массы ДО (мг/кг, г/кг).
2.1.5 Уровни токсического действия, в том числе ПДУДО,
устанавливаются как для индивидуальных химических веществ, так и для природных
смесей, таких как нефть (см. Приложение
А). При этом методические подходы остаются одинаковыми.
2.1.6 Методики предусматривают использование
разнообразных грунтов - песка, глины, ила, заиленного песка, либо стандартный
субстрат - песок - окисленный серый ил (1:1), характеризующийся следующими
показателями:
а) величина водородного показателя (рН) - 6,5-8,5;
б) содержание органического вещества (по потере при
прокаливании) - до 10%;
в) содержание азота аммонийного - до 2,0, нитритов -
до 0,1, нитратов и фосфатов до 10,0 мг/100 г грунта.
2.1.7 Опыты проводятся в системах с ДО, а не с их
экстрактом, что приближает эксперимент к природным условиям.
2.1.8 Исследования проводятся с соблюдением мер
безопасности при работе с химическими веществами согласно ГОСТ 12.4.021.
Организация обучения работающих с техникой безопасности труда согласно ГОСТ
12.0.004. Помещение лаборатории должно соответствовать требованиям пожарной
безопасности в соответствии с ГОСТ 12.1.004 и иметь
средства пожаротушения - ГОСТ
12.4.009.
2.1.9 К выполнению исследований при разработке ПДУДО
допускаются лица, освоившие методические приемы водной токсикологии, имеющие
соответствующую квалификацию и работающие в аккредитованной лаборатории [6].
2.1.10 За представление и качество образца
исследуемого вещества несет ответственность организация-заказчик.
2.2
Общие условия установления предельно допустимого уровня веществ в донных
отложениях (ПДУДО)
2.2.1 Методика определения уровней токсичности
вещества в ДО, в том числе МДУ и ПДУДО предусматривает проведение
токсикологических исследований на тест-организмах - представителях различных
трофических звеньев экологической системы, развитие и размножение которых
связанно с донными грунтами (организмы фито-, зообентоса и бентосо-ядные рыбы).
Для контроля десорбции химических веществ
используются чувствительные планктонные тест-организмы - Daphnia magna Straus и
Scenedesmus quadricauda (Тurp) Breb.
Рекомендуемые тест-объекты:
- бактерии - общее количество бактерий (ОБК),
удельная активность (УА) бактерии (по величине темновой ассимиляции СО2),
численность сапрофитных, гетеротрофных и специфических (например
нефтеокисляющих, фенолооксиляющих и т.д.) микроорганизмов;
- водоросли Scenedesmus quadricauda (Turp) Breb,
Cyanophytae (для оценки эвтрофирующего эффекта)
- макрофиты - Elodea canadensis Rich, Lemna minor Linne,
Vallisneria spiralis Linne;
- простейшие - Paramecium caudatum Ehrcnberg;
- ракообразные - Daphnia magna Straus, Hyalella azteca Saussure,
Gammarus lacustris Sars, Asellus aquaticus Linne;
- моллюски - Limnaea stagnalis Linne, Limnaea fragilis Linne,
Planorbarius purpura Muller, Anisus albus Muller;
- черви - Limnodrilus hoffmeisteri Claparede, Limnodrilus
udekemianus Claparede, Tubifex tubifex O.F. Muller;
- личинки насекомых - Chironomus
dorsalis Meigen, Ch. plumosus Linne, Ch. thummi Kieffer, Ch. riparins Meigen;
- бентосоядные рыбы - эмбрионы и личинки осетровых Acipenser baeri
Brandt (осетр), Acipenser ruthenus
marsilii Brandt (стерлядь); карповых, аквариумных; личинки сиговых (род Coregonus); личинки и сеголетки карповых - Cyprinus carpio Linnaeus; взрослые - аквариумные - Brachydanio rerio, сомики
2.2.2 Для каждого тест-организма установлен перечень
основных тест-реакций, которые должны контролироваться в обязательном порядке,
а также - дополнительные показатели, с помощью которых можно исследовать
механизм действия токсиканта. Целесообразность использования дополнительных
тестов определяется в каждом конкретном случае, исходя из задачи.
2.2.3 Диапазон реагирования
тест-культур периодически контролируется по эффекту воздействия на них
эталонных токсикантов - бихромата калия и фенола в соответствии с критерием
острой летальности (ЛК50) в течение 24-96 ч., либо полуэффективной
концентрации ЭК50, (например гашение люминесценции фотобактерий за
0,5 ч.).
2.2.4 Набор тест-объектов может быть расширен за
счет рекомендуемых и апробированных биотестов, исходя из задач и возможностей
той или иной токсикологической лаборатории.
2.2.5 Для оценки класса опасности, а также
необходимости и периодичности смены ДО и воды в опытах, исследуют стабильность
вещества в ДО. Если вещество стабильно (время 95% распада вещества более 1
месяца), смену ДО можно не производить, а воду (50 %) следует менять 1 раз в
5-10 сут. для предотвращения накопления и негативного действия продуктов
метаболизма гидробионтов.
2.2.6 При выборе для
исследований концентраций вещества в ДО следует исходить из следующего:
- предварительные опыты для оценки острой
токсичности ДО проводят с помощью экспресс-метода на люминесцирующих бактериях
- Photobacterium phosphoreum, Photobacter fisheri (0,5 ч.), простейших
Paramecium caudatum (2 ч.), Hyalella azteca (24 ч.) или других чувствительных
организмах. Для этого готовится серия разведений (5-6), различающихся между
собой в 10 раз, из исходного сильно загрязненного грунта чистым грунтом. Острый
опыт служит для определения степени токсичности вещества, а также диапазона
концентраций в ДО при проведении хронических опытов;
- для проведения хронического эксперимента готовится
серия разведений, различающихся в 2-5 раз в зависимости от крутизны связи -
концентрация - эффект.
2.2.7 В систему испытаний включен транслокационный
тест - накопление вещества по трофической цепи. Накопление вещества рыбами
изучается в системе: загрязненный грунт - олигохеты, хирономиды - сеголетки
карпа. Коэффициент кумуляции определяется как отношение концентрации вещества в
единице ткани рыб к таковой в воде, ДО или кормовых объектах.
2.2.8 Генотоксичность веществ определяется не менее
чем на двух тест-системах по действию на дифференциальную активность генов
(проявление пуффинга в процессе метаморфоза личинки в куколку) в слюнных
железах хирономид - Chironomus plumosus или Chironomus thummi; цитогенетические
нарушения в клетках корней элодеи, ряски, и др. укореняющихся макрофитов, а так
же эпителии рыб; мутагенность и терратогенность - на насекомых (Drosophyla
melanogaster) и эмбрионах рыб.
2.2.9 Влияние нормируемого вещества на процессы
самоочищения исследуется с помощью гидрохимических и микробиологических тестов:
рН, еН, О2, БПК5, окисляемость перманга-натная,
содержание аммония, нитритов, нитратов, фосфатов и уровень развития сапрофитной
микрофлоры.
2.2.10 Характеристикой токсичности вещества служат
величины концентраций, вызывающие определенный токсический эффект (эффективные
- ЭК25, ЭК50, ЭК100 и летальные - ЛK25,
ЛК50, ЛК100 концентрации), в остром и хроническом
эксперименте.
2.2.11 Конечной целью исследований является
определение ПДУДО т.е. установление предельно допустимого уровня
вещества в донных отложениях, не оказывающего устойчивого эффекта ни на один из
учитываемых показателей.
2.2.12 Анализ полученных данных заключается в
следующем:
- все результаты, полученные при действии
исследуемого вещества в ДО («опыт»), сопоставляются с результатами наблюдений
при отсутствии данного вещества в ДО («контроль»);
- эффективными считаются концентрации в ДО, которые
вызывают как токсический, так и эвтрофирующий эффект (например, увеличение
численности продуцентов);
- достоверность различий результатов, полученных в
опыте и контроле, оценивается методами вариационной статистики (см. раздел раздел
4), и все концентрации, вызывающие достоверные различия между ними,
рассматриваются как действующие; при отсутствии статистически достоверных
отличий в виду малой выборки (3 повторности) можно считать безвредной (МДУ)
величину содержания вещества, при котором показатели отклоняются от контроля не
менее, чем на 20%, отклонение равное 20% считается пороговой концентрацией.
- на основании статистической обработки данных и
графического анализа устанавливаются максимально допустимые уровни (МДУ) для
каждой тест-реакции использованных организмов. Самая низкая величина
рассматривается как МДУ для данного тест-объекта. Самая низкая величина МДУ, установленная
для наиболее чувствительного тест-объекта, рассматривается как предельно
допустимый уровень (ПДУДО).
2.2.13 Лимитирующим показателем вредности (ЛПВ) при
разработке ПДУДО может быть токсикологический («токс.»), санитарный
(«сан.») и санитарно-токсикологический («сан.-токс.).
2.3.
Основные требования к материалам, представляемым на утверждение норматива ПДУДО
2.3.1 Протоколы, включающие результаты исследований,
должны быть оформлены в виде, обеспечивающем бессрочное хранение и возможность
проверки.
2.3.2 Материалы по проведенным исследованиям
оформляют в соответствии с требованиями ГОСТ
7.32-2001, в виде отчета, аннотационных карт по каждому веществу и
направляют для рассмотрения их на НТС МПР России и/или НТС Главрыбвода.
- Отчет по установлению уровней токсичности ПДУДО
химического вещества содержит:
а) обоснование проведения работы, характеристику
нормируемого вещества, включая химический состав, строение и свойства,
характеристику используемой воды, ДО, тест-организмов и тест-реакций, условия и
подготовка к выполнению экспериментальных работ;
б) методики выполнения работ, характеристику
погрешности методик, способы учета и анализа результатов. При необходимости
расширения перечня тест-объектов или тест-реакций необходимо обоснование этого
в отчете;
в) обработанные
количественные токсикологические данные по каждому тест-объекту и каждой
тест-реакции в виде таблиц, графиков, диаграмм с результатами статистической
обработки и с обоснованным заключением по допустимым концентрациям для каждого
объекта.
В Заключении дается обобщенный анализ результатов,
сведенных в таблицу по экологическим звеньям и тест-объектам, с выводом об
уровнях порогового, сублетального и летального действия, а также о предлагаемой
величине ПДУДО, классе опасности вещества и лимитирующему показателю
вредности (ЛПВ).
2.3.3 Если для нормируемого вещества установлены ПДК
в воде, класс опасности дается по предварительно установленным данным.
2.3.4 К отчету прилагается химический паспорт
нормируемого вещества.
2.4.
Основные условия организации разработки и утверждения норматива
2.4.1 Разработку нормативов - ПДУДО на
основании токсикологических исследований проводят научно-исследовательские
институты, ВУЗы и другие специализированные организации, независимо от их
ведомственной принадлежности и форм собственности, аттестованные на разработку
нормативов качества окружающей среды, в том числе нормативов ПДК химических
веществ в воде водных объектов.
2.4.2 Штатный состав аттестованной лаборатории
должен обеспечивать ее деятельность в объеме, определяемом областью аттестации,
и включать специалистов, имеющих профессиональную подготовку, квалификацию и
опыт в проведении испытаний, предписанных методическими указаниями [7].
2.4.3 Токсикологические
исследования должны выполняться в соответствии с настоящим Руководством.
2.4.4 Разработанный норматив - ПДУДО
после заключения экспертов и рассмотрения на НТС МПР России или НТС Главрыбвода
утверждается в установленном порядке как норматив, используемый для оценки
качества ДО поверхностных водных объектов.
3. МЕТОДЫ
ОПРЕДЕЛЕНИЯ МАКСИМАЛЬНО ДОПУСТИМЫХ УРОВНЕЙ (МДУ) ВЕЩЕСТВ В ДОННЫХ ОТЛОЖЕНИЯХ
3.1 Подготовка сред для проведения испытаний
3.1.1 Донные отложения (песок, окисленный ил)
отбирают дночерпателями (модели Петерсена, Экмана, Берджа) на чистых участках
реки или озера по ГОСТ
17.1.5.01-80
3.1.2 Донные отложения высушивают до воздушно-сухого
состояния, удаляют остатки растений, камни и т.д., измельчают в ступке и
просеивают через сито с диаметром отверстий 1 мм. Песок промывают чистой
питьевой водой, сливая воду с мелкими, пылеватыми частицами. Готовят
стандартный грунт-смесь песка и ила (1:1). Размер частиц смеси - от 0,005 до
1,0 мм (песок 0,5-1,0 мм, ил 0,005-0,5 мм).
Некоторые химические параметры стандартных ДО
приведены в таблице 3.1.
Таблица 3.1
Некоторые
показатели химического состава стандартных ДО (мг/100 г)
|
ДО |
рН |
N/NH4+ |
N/NO2 |
N/NO3 |
Р/Р2О5 |
OB (по ППП%) |
|
Песок + ил (1:1) |
6,3-7,55 6,9 |
0,7-3,8 1,7 |
0,0-0,1 0,02 |
0,6-5,5 3,4 |
0,1-8,2 5,3 |
3,6-4,9 4,4 |
Требования
к стандартным ДО:
- величина водородного показателя (рН) - 6,5-7,5;
- содержание органического вещества (по потере при
прокаливании - ППП) - до 10%;
- содержание азота аммонийного - до 2,0, нитритов -
до 0,1, нитратов и фосфатов - до 10,0 мг/100 г грунта.
Для хранения грунтов используют стеклянную или
эмалированную посуду.
3.1.3 ДО анализируют на
наличие токсикантов (гидрофобные компоненты, в т.ч. нефтепродукты, пестициды,
тяжелые металлы), органическое вещество, рН, еН, количество биогенов (азот,
фосфор).
3.1.4 Воду для гидрохимических и микробиологических
экспериментов отбирают из чистых водоемов (озер) в соответствии с ГОСТ
17.1.5.05-85 в количестве, указанном в соответствующих методиках. Воду
фильтруют через газ-сито № 64-77 для удаления взвеси и гидробионтов. Отбираемый
объем должен быть в два раза больше требуемого и храниться до конца
эксперимента. Проводят полный гидрохимический анализ в аккредитованной
лаборатории по аттестованным методикам.
3.1.5 Для экспериментов с тест-объектами используют
природную или дехлорированную питьевую воду. Воду отстаивают в течение 7-10
сут. и, при необходимости, пропускают через гравийно-песчаный фильтр с активированным
углем.
3.1.6 Вода должна соответствовать требованиям,
предъявляемым к воде рыбохозяйственных водоемов (ГОСТ
17.1.2.04-77, ГОСТ
17.1.3.07-82).
3.1.7 Для воспроизводимости
результатов при получении ряда концентраций загрязняющих веществ в ДО
производят следующие предварительные процедуры. Подготовленные ДО взвешивают,
вносят определенное количество загрязняющего вещества, тщательно перемешивают,
оставляют на двое суток, затем приливают воду в соотношении, указанном в
соответствующем разделе данного Руководства. При внесении в донные отложения
сырой нефти (или других ПАВ) воду сливают до исчезновения пленки на поверхности
воды. Определяют остаточную концентрацию загрязняющего вещества в донных
отложениях. Вариационно-статистические характеристики предлагаемой методики (на
примере нефти) представлены в таблице 3.2.
Таблица 3.2
Вариационно-статистические
характеристики метода внесения нефти в донные отложения (остаточное количество
нефти после отмывки)
|
Тип грунта |
Число выборки, n |
Среднее арифметическое, Х±mx, г/кг |
Среднее квадратическое, σ±mσ |
Коэффициент вариации, CV±mcv, % |
|
Песок |
10 |
24,25±0,62 |
1,87±0,44 |
7,71±1,82 |
|
Глина |
10 |
23,16±0,98 |
3,11±0,70 |
13,42±3,00 |
|
Ил |
10 |
27,55±0,74 |
2,34±0,52 |
8,49±1,90 |
|
Торф |
10 |
24,30±0,73 |
2,54±0,52 |
10,43±2,13 |
|
Примечание - Концентрация внесенной в грунт нефти 50 мл/кг или 40 г/кг (плотность нефти - 0,8 г/см3). |
||||
3.1.8
Для определения летальной и эффективной концентраций загрязняющего вещества в
донных отложениях готовят серию (не менее пяти) разбавлений из исходных ДО.
Исходный грунт с определенной концентрацией нормируемого химического вещества
смешивают с чистым грунтом в разных соотношениях.
Вариационно-статистические
характеристики относительных показателей концентраций вещества (%) в ДО (на
примере нефти), полученных при смешивании загрязненного и чистого грунта,
представлены в таблице 3.3.
Таблица 3.3
Вариационно-статистические
характеристики относительных показателей концентраций нефтепродуктов (%)
|
Разбавление, раз (%, расчетное) |
Среднее арифметическое, Х±mx, (%, фактическое) |
Среднее квадратическое, σ±mσ |
Коэффициент вариации, CV±mcv, % |
|
2 (50 %) |
47,25±2,48 |
4,97±1,76 |
10,52±3,72 |
|
4 (25%) |
23,50±1,25 |
2,50±0,88 |
10,64±3,76 |
|
8 (12,5%) |
12,50±1,15 |
2,29±0,81 |
18,33±6,48 |
|
16 (6,25%) |
7,25±0,89 |
1,79±0,63 |
24,63+8,71 |
|
32 (3,125 %) |
4,25±0,74 |
1,48±0,52 |
34,80±12,30 |
3.1.9
Соотношение воды-ДО определено конкретно для каждого тест-объекта. Данные
приведены в разделах.
3.1.10 Измерения нормируемого вещества должны
осуществляться по аттестованным методикам количественного химического анализа.
3.2 Оценка стабильности вещества и стабильности его токсичности в донных отложениях
3.2.1 Принцип метода
Метод оценки стабильности вещества основан на
определении его остаточной концентрации в ДО в динамике аналитическим методом.
Критерием стабильности является время убывания концентрации вещества на 95% в
залитых водой ДО.
Метод оценки стабильности токсичности вещества
основан на определении остаточной суммарной токсичности вещества и продуктов
его трансформации в ДО с помощью тест-организмов - фотобактерий и дафний.
Критерием остаточной токсичности вещества в ДО является снижение интенсивности
люминесценции фотобактерий и выживаемости 50 % дафний во взвеси загрязненных ДО
(на уровне ЛК50) в динамике (на 1, 3, 5, 10, 20, 30 сут.).
3.2.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
приведены в подразделах 3.3
(химико-аналитический метод), 3.5
(биолюминесценция) и 3.9
(дафнии).
3.2.3 Условия выполнения исследований
Исследования проводят в лаборатории без посторонних,
вредных испарений и газов при температуре плюс 20±4°С.
Условия культивирования и содержания тест-культур
приведены в подразделах 3.5
и 3.9.
Результаты биотестирования учитывают, если ЭК50
за 30 мин. для культур Photobacterium phosphoreum или Photobacter Fisheri
находилась в интервале 0,5-1,2 мг/дм3, для Daphnia magna - в
диапазоне 0,9-2,2 мг/дм3 К2Сr2О7.
3.2.4 Подготовка к выполнению исследований
До начала биотестирования реактивируют
лиофилизованную культуру фотобактерий (подраздел 3.5)
и получают достаточное количество суточных дафний.
Для проведения предварительного и основного опытов
используют суточную молодь дафний, которую отделяют из культуры через газ-сито
№ 23 или путем отлавливания стеклянной трубкой.
Готовят ДО, воду и вносят исследуемое вещество в ДО
(см. подраздел подраздел
3.1).
3.2.5 Проведение исследований
Исследование проводят в системе ДО - вода
(контроль), ДО - вещество - вода (опыт). Число повторностей - 3. Соотношение ДО
и воды -.1:9, объем - 1,0 дм3. В день закладки опыта готовят серию
стаканов (1 дм3) по числу отбора проб - на 0, 1, 3, 5, 10, 20, 30
сутки и контроль (в 3-х повторностях), соответственно маркируют стаканы - № 0,
1, 3, 5, 10, 20, 30. В предварительном опыте с фотобактериями и дафниями
определяют острую токсичность вещества в серии разведений ДО. ЭК50,
(0,5 ч) для фотобактерий и ЛK50 (24 ч.) для дафний определяют
методом пробит - анализа.
Создают в ДО концентрацию исследуемого вещества,
соответствующую большей из определенных в предварительном опыте. Раскладывают
во все стаканы по 100 г загрязненных ДО и заливают дехлорированной,
аэрированной питьевой водой (или водой из чистого водоема) - 900 см3.
Стаканы ставят на стеллажи в помещении с естественным освещением и температурой
плюс 22±2°С. Поверхность воды открыта, рН воды - 7,5+1. В контроле определяют
фоновую концентрацию исследуемого вещества в ДО и воде.
В день замера токсичности в 3-х параллельных
стаканах в контроле и опыте взмучивают ДО в течение 1 ч. с помощью магнитной
мешалки. Берут по 1,0 см3 взвеси, вносят навеску NaCl для получения
концентрации 3 %, одновременно вносят по 20 мм3 суспензии бактерий.
Через 0,5 ч. декантат переносят в кювету биолюминометра и определяют уровень
люминесценции.
После оседания взвеси в стакан помещают односуточных
дафний по 10 экз.в повторность и контролируют их выживаемость в течение суток.
Рачков не кормят. Аналогичные действия производят в последующие сутки опыта (1,
3, 5, 10, 20, 30). Выживших рачков изымают через 24 ч, считают, просматривают
под бинокуляром с целью определения их состояния. Данные заносят в протокол.
В воде и ДО определяют остаточное содержание
исследуемого вещества.
Аналогичные процедуры производят на каждый срок
опыта.
3.2.6 Учет и оценка результатов
На основании результатов трех параллельных
определений в контроле и в опыте находят среднее арифметическое уровней гашения
люминесценции, выживаемости дафний и остаточное содержание вещества в воде и
ДО. Полученные результаты заносят в таблицы и на основании полученных данных
строят графики зависимости изменения токсичности (снижение биолюминесценции за
0,5 ч. и гибели дафний за 24 ч. от срока, прошедшего после приготовления
системы) и убывания концентрации вещества в ДО во времени.
Расчет стабильности вещества проводят методом
регрессии, с учетом того, что убывание концентрации вещества имеет
экспоненциальный характер и описывается уравнением
lgC=LgCo-t/τ,
где С -
концентрация вещества в мг/дм3,
Со - исходная концентрация,
t - время в сутках,
τ - константа
скорости убывания веществ в сутках.
Коэффициенты этого уравнения на основании полученных
экспериментальных данных вычисляют методом регрессии.
Если принять y=lgC, a=lgCo,
x=t и в=-1/τ, то уравнение приобретает вид:
у=а+в·х.
Вычисляют «а» и «в» методом
наименьших квадратов по уравнениям:
![]()
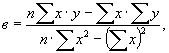
где n - число определений во
времени.
По этому уравнению определяют время уменьшения
концентрации вещества на 95%.
Этот показатель может быть определен и графически,
для чего строят график убывания концентрации. На осях откладывают время и
логарифм концентрации. Из точки прямой, соответствующей логарифму 5% вещества
от исходного уровня, опускают перпендикуляр. Точки пересечения его с осью
времени определяют срок разрушения 95% вещества.
По степени стабильности вещество относят к одной из
шести групп [3],
каждой из которых соответствует определенный коэффициент запаса - Кc (таблица 3.4).
Таблица 3.4
Классификация
вещества по их стабильности в ДО (τ=95%)
|
Группа |
Стабильность |
Время 95% распада, сут. |
Коэффициент запаса (Кс) |
|
1 |
малая |
до 10 |
1,0 |
|
2 |
умеренная |
11-60 |
2,5 |
|
3 |
средняя |
61-90 |
7,5 |
|
4 |
высокая |
91-180 |
13,5 |
|
5 |
очень высокая |
181-365 |
27,0 |
|
6 |
сверх высокая |
более года |
- |
|
Примечание - Кс - при вынесении решения о величине ПДК для пестицидов в воде. |
|||
В
качестве срока деструкции вещества служит период, через который токсичность ДО
снизится на 95%, т.е. за 0,5 ч. интенсивность гашения биолюминесценции (Т) не
будет превышать величину 0,3 (см. подраздел 3.5),
а гибель дафний за 24 ч. составит не более 2,5%. Если за время испытаний такое
снижение не наступит, то может быть проведена графическая экстраполяция.
Если в процессе испытаний гибель рачков возрастает,
значит продукты деградации более токсичны, чем исходное вещество. Это следует
учитывать при оценке экологического риска.
3.3 Установление максимально допустимого уровня вещества в донных отложениях по изменению химико-аналитических показателей, характеризующих процесс самоочищения
3.3.1 Принцип метода
Метод основан на установлении различий между
контрольными (ДО - вода) и опытными (ДО - вещество-вода) системами по
показателям растворенного в воде кислорода, аммонийного, нитритного и
нитратного азота, фосфатов, величин БПK5, окисляемости, рН и еН.
Методика определения токсичности загрязненных ДО
основана на способности нормируемого вещества изменять активность сапрофитов и
бактерий нитрификаторов, что выражается в изменении содержания в воде продуктов
их метаболизма, а также рН и еН среды. Критерием токсического действия
загрязненных ДО на процесс самоочищения являются статистически достоверные
отличия величины показателей БПК5, нитрификации, окисляемости и
содержания О2 в придонном слое воды и изменения рН - на 1,0 ед. в
опытных вариантах по сравнению с контролем. При отсутствии статистически
достоверных отличий в виду малой выборки (три повторности) можно считать
безвредной (МДУ) величину содержания вещества, при котором показатель качества
среды отклоняется от контроля не менее, чем на 20%. Для расчета концентрации,
вызывающей 20% отклонение, можно воспользоваться формулой для БПК5
из [3].
![]()
где С -
концентрация вещества, вызывающая отклонения показателя от контроля на 20%,
С1 и С2 - концентрация вещества,
вызывающая отклонения от контроля менее и более чем на 20% соответственно,
N1 и N2 - величины этих отклонений.
Концентрации вещества в ДО, отклоняющие показатель
качества придонного слоя воды более чем на 20% считаются действующими,
отклоняющие на 20% - пороговыми.
Химические анализы (таблица 3.5) проводятся в
аккредитованной лаборатории по аттестованным методикам [8].
Таблица 3.5
Наименование
нормативных и других документов, устанавливающих методы контроля показателей
качества воды
|
Контролируемые показатели |
Документы |
|
БПК |
РД 52.24.420-94 |
|
ИСО 5815:1989 |
|
|
еН |
ПНД Ф 14.1:2:3:4.123-97 |
|
Водородный показатель, рН |
РД 52.24.495-94 |
|
Нитраты |
ПНД Ф 14.1:2.4-95 |
|
РД 52.24.380-94 |
|
|
ПНД Ф 14.1:2.3-95 |
|
|
ПНД Ф
14.1:2:4.25-95 |
|
|
Нитриты |
РД 118.02.27-88 |
|
РД 52.24.381-94 |
|
|
Аммонийный ион |
ПНД Ф 14.1.1-95 |
|
Растворенный кислород |
РД 52.24.419-95 |
|
Окисляемость перманганатная |
Руководство по химическому анализу поверхности вод суши, под ред. А.Д. Семенова, 1973 г. |
3.3.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Применяются следующие устройства измерений и
материалы:
- аквариумный микропроцессор АЭИ, объем аэрации 7,2
л/мин.;
- весы лабораторные для общего назначения, ГОСТ
24104-88;
- вода дистиллированная, ГОСТ 6709-72;
- воронки лабораторные, ГОСТ
25336-82;
- кислородные склянки вместимостью около 100-200 см3;
- мерные колбы на 50, 100, 200, 250, 500 и 1000 см3,
ГОСТ
25336-82;
- пробирки, бюретки, пипетки ГОСТ
29227-91, ГОСТ
29251-91;
-стаканы химические объемом 0,1-1,0 дм3, ГОСТ
25336-82;
- стеклянные аквариумы объемом 30 дм3;
- стеклянная трубка с загнутым концом (2-3 см) для
отбора проб придонной воды;
- термостат с водяной рубашкой для поддержания
температуры 20°С и выше;
- термометр лабораторный с ценой деления шкалы 1°С, ГОСТ 112;
- фотоэлектроколориметр КФК-2 с погрешностью не
более 1,0%, КФК-3 - 0,25% или спектрофотометр;
- чашки Петри, ГОСТ
25336-82;
- рН-метр, 0-14 ед. рН с погрешностью ±0,05 рН.
Перечень необходимых реактивов приведен в [8].
3.3.3 Условия выполнения исследования
Предварительные работы по подготовке воды,
экспериментальных систем (ДО-вода) проводят в помещении без вредных
испарений и газов при температуре 20±4°С. Внесение в ДО исследуемого вещества
(в частности, гидрофобных веществ), удаление пленки, сушка загрязненных ДО,
определение остаточной концентрации производят в специальном помещении с
зонтами и вытяжными шкафами. Подготовку воды и ДО, внесение исследуемого
вещества в ДО и приготовление серии разведений производят, как указано в
подразделе 3.1. Соотношение ДО и воды
в экспериментальных моделях - 1:9 по массе (10% ДО). Для опытов используют
аквариумы на 10-30 дм3, которые располагают на стеллажах в помещении
с естественным освещением. Температура воздуха 20±4°С.
Воду для анализов отбирают сифоном (стеклянная
трубка с загнутым на 2 см концом) из придонного слоя, не взмучивая грунт.
Длительность эксперимента обусловливается временем,
необходимым для прохождения полной минерализации азотсодержащей органики до
стабильной формы азота в виде нитратов.
3.3.4 Выполнение исследований
Подготовленные ДО (4-5 концентраций - опыт, и чистый
грунт - контроль) распределяют равномерным слоем на дне аквариумов и заливают
подготовленной водой до уровня, соответствующего 1:9 по массе, 3 повторности в
каждом варианте.
Отбор проб начинают после оседания взвеси
(визуально): на исходные, 1, 3, 5, 10, 20, 30 сутки. Определяют тест-показатели
(см. 3.3.1) по
методикам (таблица
3.5).
3.3.5 Учет и оценка результатов
На основании результатов трех повторностей в
контроле и трех повторностей каждой концентрации в опыте на каждый срок отбора
проб проводят статистический анализ (см. раздел
4). Все полученные данные заносят в таблицу, которая служит официальным документом
выполненных экспериментов. По данным таблицы строятся графики зависимости -
концентрация - эффект.
Для количественной оценки токсичности загрязненных
ДО устанавливают эффективные концентрации ЭК0 ЭК25, ЭК50
по каждому показателю. Для расчета ЭК строят графики. На оси абсцисс
откладывают логарифмы концентраций исследуемого вещества в ДО, на оси ординат -
проценты изменения снижения величины показателя от исходной, которые переводят
в пробиты. Через полученные точки проводят линию регрессии. Из точки на оси
ординат, которая соответствует 25 и 50% снижению, проводят линию до пересечения
с линией регрессии. Из точки пересечения опускают перпендикуляр на ось абсцисс
и по антилогарифму определяют искомые концентрации (ЭК0, ЭК25,
ЭК50).
3.4 Установление максимально допустимых уровней вещества в донных отложениях по микробиологическим показателям
3.4.1 Принцип метода
Метод основан на установлении различий между уровнем
микробиологических показателей (численность сапрофитных бактерий, скорость
размножения сапрофитов и определение общей активности микробного сообщества,
численность специфических микроорганизмов, в частности, нефтеокисляющих) в
испытуемых пробах модельных грунтов с различной концентрацией вещества и
контролем (модельный грунт без внесения вещества).
Критерием токсичности исследуемого вещества для
естественного бактериального сообщества ДО является снижение в опытах по
сравнению с контролем микробиологических показателей на 50% и более при
продолжительности эксперимента 24-120 ч.
3.4.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- автоклав, обеспечивающий стерилизацию в течение 60
мин. при давлении в 1атм.;
- бактериологические колбы на 0,5-1,0 дм3
по 2 кл. точности, ГОСТ
1770-74;
- бактериальный краситель «Эритрозин»;
- бактериологические мембранные ультрафильтры с
размером пор 0,15-0,25 мкм и диаметром 2,5-3,5 см;
- бактериологические пробирки и пипетки на 1 см3,
ГОСТ
29227-91;
- бактериологический термостат;
- бинокулярная лупа, ГОСТ
25706-83;
- бокс с кварцевой лампой;
- бумага фильтровальная, ГОСТ 12026-76;
- вакуумный насос;
- весы технические 2 класса с разновесами, ГОСТ
24104-80;
- вода дистиллированная, ГОСТ 6709-72;
- дозаторы пипеточные на 100-500 мм3 со
стерильными насадками, ГОСТ
28311-89;
- жидкостный сцинтилляционный счетчик с набором
специальных флаконов;
- иммерсионное масло для микроскопии, ГОСТ
13739-78;
- индикатор метиловый красный;
- кислота соляная 0,1 N, ГОСТ 3118-77;
- кюветы (эмалированные) объем 100-500 см2;
- мельничный газ № 76, ГОСТ
4403-91;
- мембранные фильтры «Владипор» с размером пор 0,2
мкм и диаметром 35 мм;
- мешочки из светонепроницаемого материала;
- микроскоп МБИ-6, ГОСТ
8074-82;
- оборудованный блок для работы с радиоактивными
веществами 2 класса, ОСП-72-87;
- пипетки мерные емкостью 25-100 см3, ГОСТ
29227-91;
- пипетки химические градуированные емкостью 1-2 см3,
ГОСТ
29227-91;
- предметные стекла, ГОСТ 9284-75;
- питательная среда стандартизованная;
- склянки темного стекла емкостью 110-120 мл под
герметичной пробкой;
- стеклянные широкогорлые сосуды емкостью 500-700 мл
с крышками, ГОСТ
25336-82;
- сушильный шкаф, обеспечивающий температуру 180°С в
течение 2 часов;
- стерильный раствор радиоактивного препарата Na214СO3
активностью около 10 mkku в ампулах;
- сцинтилляционная жидкость типа ЖС-17;
- титровальная бюретка объемом 10-20см3, ГОСТ
25336-82;
- фильтровальные воронки под мембранные фильтры
диаметром 35 мм, ГОСТ
25336-82;
- формалин 40%, ГОСТ 1625-89;
- химические пипетки 1, 2, 5, 10 см3, ГОСТ
29227-91;
- химические стаканы на 250-500 см3, ГОСТ
25336-82;
- чашки Петри, ГОСТ
25336-82;
- шпатели металлические медицинские;
- штативы, спиртовка, спирт этиловый, ГОСТ
18300-87.
3.4.3 Условия выполнения исследования
Предварительные работы по подготовке и стабилизации
микрокосмов с испытуемыми грунтами проводят в помещении без вредных испарений и
газов при температуре 20±4°С.
Методы изготовления, стерилизации, хранения и
подготовки сред к посевам, а также техника стерильного посева указаны в [8,
9,
10].
Все подготовительные и основные работы, связанные с использованием
радиоактивного материала, проводятся в специально оборудованном, официально
зарегистрированном и регулярно проверяемом блоке, предназначенном для
радиационных работ 2 и 3 класса (ОСП-72-87, 1988).
Интенсивность клеточного β-излучения измеряется
на жидкостном сцинтилляционном счетчике типа «MARK-2» в виде количества
импульсов за единицу времени и пересчитывается на интенсивность ассимиляции 14СО2,
выражаемую в весовых единицах углерода на объемную единицу испытуемой пробы
(или на бактериальную клетку) за единицу времени. Объем пробы надгрунтовой
жидкости для постановки эксперимента по определению темновой ассимиляции (ТА)
должен быть не менее 100 см3. Количество повторностей каждого
эксперимента - не менее 3-х. Объем единичной пробы для определения
интенсивности бактериального β-излучения должен быть не менее 25 см3.
Для контроля используется надгрунтовая жидкость микрокосма без добавления нормируемого
вещества.
3.4.4 Подготовка к проведению исследований
Подготовка микрокосмов. Насыщение грунта веществом
(на примере нефти) производится, как указано в 3.1. Готовятся
«разведения» исходного загрязненного грунта незагрязненным в соотношении 1:1,
1:2, 1:3, 1:5, 1:7, 1:9 и т.д. Из каждого варианта грунтового «разведения» и
воды в широкогорлых стеклянных сосудах, объемом 500-700 см3, с
крышками приготавливаются природные модели (микрокосмы) в соотношении грунт:
вода - 1:4. Микрокосмы стабилизируются в течение 72 ч. для восстановления
естественного бактериального сообщества.
3.4.5 Проведение исследований по определению численности сапрофитов
Перед посевами из грунтов каждого варианта опыта (в
трех повторностях) приготавливают болтушки разведений (от 1 до 7) в пробирках
со стерильной питьевой водой. Мерной трубкой (химическая пипетка с обрезанным
концом вместимостью 2 см3) отбирают 1 см3 грунта из
поверхностного слоя и переносят в пробирку, вмещающую 9 см3 воды,
тщательно перемешивают и 1 см3 суспензии переносят в следующую
пробирку со стерильной водой и т.д. Суспензиям разведений дают отстояться 7-10
мин. Посев производят глубинным способом в чашках Петри в 3-х кратной
повторности от каждого необходимого разведения. Каждую засеянную чашку заливают
предварительно расплавленной и остуженной до 35°С средой. Бактерии проращивают
в термостате при плюс 20°С.
3.4.6 Подготовка и проведение определения скорости размножения сапрофитных
бактерий
Приготавливаются «болтушки» из испытуемого грунта и
надгрунтовой воды микрокосмов (по 20 см3) в соотношении 1:9. Пробы
фильтруют в стерильные «пенициллиновые» флаконы через дважды прокипяченный
двойной фильтр из мельничного сита (не реже № 76), заправленный в обработанную
спиртом бактериальную фильтровальную воронку. Из флаконов с фильтратами
«болтушек» опытных микрокосмов производятся глубинные посевы в чашки Петри в
трехкратной повторности от каждого разведения. Каждую засеянную чашку заливают
предварительно расплавленной и остуженной до 35°С средой.
Бактерии проращивают в термостате при температуре
20°С. Флаконы с фильтратами инкубируются в термостате при 20°С 24 часа, после
чего проводится повторный посев на питательную среду.
3.4.7 Подготовка и проведение определений интенсивности темновой ассимиляции 14СО2
После стабилизации микрокосмов, из них мерной
пипеткой отбирается по 100 см3 надгрунтовой жидкости и переносится в
склянку объемом 110-120 мл с герметичной пробкой. В каждую склянку дозатором
вносится 0,5 см3 рабочего раствора радиоактивного изотопа Na214CO3
(около 0,1 mkku). После внесения радиоактивной метки необходимо предохранять
склянки с пробками от освещения, перенося их в светонепроницаемых мешочках.
Склянки с пробами и внесенным изотопом инкубируются
в термостате при температуре 20°С в течение 12 ч. После инкубации пробы
фиксируются 2-3 каплями 40% раствора формалина. Из каждой склянки по 25 см3
надгрунтовой воды (в трех повторностях) фильтруется через мембранный фильтр
«Владипор» с размером пор 0,20 мкм в фильтровальной воронке с помощью
вакуумного насоса при разряжении, не превышающем 0,1 атм. Меченые фильтры
отмываются на фильтровальной бумаге, смоченной 0,2 N раствором НСl, затем дистиллированной водой и
высушиваются. В надгрунтовой жидкости всех экспериментальных микрокосмов
методом стандартного титрования 0,1 N раствором НСl в присутствии индикатора метилового красного определяется содержание
карбонатов.
3.4.8 Выполнение измерений интенсивности бактериального β-излучения
Высушенные и пронумерованные мембранные фильтры с
бактериальными препаратами помещаются на дно специальных флаконов. Во флаконы с
бактериальными препаратами заливают мерной пипеткой сцинтилляционную жидкость
типа ЖС-17 (15-20 см3) и помещают в приемный контейнер жидкостного
сцинтилляционного счетчика b-излучения.
Контролем фонового излучения служат флаконы с прокипяченными мембранными
фильтрами и порцией сцинтилляционной жидкости, установленные в начале, середине
и в конце контейнера с анализируемыми пробами.
Работа с прибором, регистрация результатов
активности излучения препаратов производятся согласно инструкции к конкретному
прибору.
Данные работы выполняются при наличие специального
бокса для работы с радиоактивными изотопами.
3.4.9 Учет и оценка результатов
Учет выросших бактериальных сапрофитных колоний
производят дважды - через 3 и 6 дней визуально и под бинокулярной лупой для
учета микроколоний.
Все результаты обсчитываются по статистическим
таблицам Мак Креди [9].
Получив усредненные результаты численности бактерий для каждого варианта
микрокосмов в начале опыта и в конце его и зная продолжительность опыта (t=24
часа) можно рассчитать время генерации бактерий (L) по формуле:
![]()
где А - численность бактерий в начале опыта,
В - численность бактерий в конце опыта,
t - продолжительность опыта.
На основании результатов из трех параллельных
определений в контроле (К) и опыте (О) для каждой пробы находят среднее
арифметическое значение (X) радиоактивности микроорганизмов в данном варианте
опыта (r), выраженное в импульс/мин
в расчете на объем всей склянки [9,
10].
Зная результат измерения радиоактивности микроорганизмов в пробе, общую радиоактивность
добавленного в склянку изотопа, концентрацию в надгрунтовой жидкости
растворенных карбонатов и продолжительность инкубации с изотопом, можно
рассчитать интенсивность процесса темновой ассимиляции СО2 (ТА, мкг
С/(л сут)) бактериальным сообществом в каждом опыте из конкретного микрокосма:
![]()
где r -
радиоактивность микроорганизмов в пробе, имп./мин,
R - общая радиоактивность добавленного в склянку
изотопа, имп./мин,
k - концентрация
в надгрунтовой жидкости растворенных карбонатов, мкг С/л,
t - время инкубации с изотопом.
Расчет средней арифметической из трех параллельных
опытов дает окончательный результат активности бактериального сообщества в
условиях каждого микрокосма. Все полученные данные по интенсивности темновой
бактериальной ассимиляции СО2 вносятся в таблицу, которая служит
официальным результатом выполненных экспериментов. По данным таблицы строятся
графики, где результаты экспериментов располагаются в зависимости от
концентрации вещества в каждом из микрокосмов.
3.5 Установление максимально допустимых уровней вещества в донных
отложениях по снижению уровня биолюминесценции бактерии
3.5.1 Принцип метода
Метод основан на
установлении различий люминесценции бактерий (Photobacterium phosphoreum (Cohn)
Ford или Photobacter Fisheri) в контрольной (вода - ДО) и опытной (вода - ДО -
нормируемое вещество) системах.
Критерием токсичности загрязненных ДО является
степень гашения люминесценции бактерий в опыте по сравнению с контролем на 25%
и более.
Люминесценцию бактерий измеряют при помощи
биолю-минометра типа Emilite 1003A (или аналогов). Гашение люминесценции
выражают в условных единицах.
3.5.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Применяются следующие средства измерений,
устройства, материалы, реактивы:
- биолюминометр с набором кювет (типа Emilite
1003A), интенсивность света 6,5×108 фотон/сек, л=425 нм;
- бумага фильтровальная, ГОСТ 12026-76;
- вода дистиллированная, ГОСТ 6709-72;
- дозаторы пипеточные на 20-1000 мм3, ГОСТ
28311-89;
- калий двухромовокислый, ГОСТ 4220-75;
- кислота соляная, ГОСТ 3118-77;
- колбы мерные емкостью - 0,5-1,0 дм3, ГОСТ
1770-74;
- натрия гидроокись, ГОСТ 4328-77;
- натрий хлористый, ГОСТ 4233-77;
- термометр с ценой деления шкалы 0,5°С, ГОСТ
112-78;
- холодильник, обеспечивающий температуру от минус
15 до плюс 6°С;
- цилиндры мерные емкостью 10 см3, ГОСТ
1770-74.
3.5.3 Условия выполнения исследований
Исследования проводят в помещении без вредных
испарений и газов, при температуре 20±4°С.
Лиофилизированную культуру фотобактерий до опыта
следует хранить в запаянной ампуле или стерильном флаконе в морозильной камере
при температуре минус 15±1°С. В таком состоянии культура пригодна для работы в
течение 1 года. После вскрытия ампулы оставшуюся после исследования культуру
следует также хранить в холодильнике. Ее следует использовать в течение 2-х
недель, поскольку активность ее быстро падает. Данные результатов опыта следует
постоянно при каждом замере соотносить с контролем.
Для обеспечения оптимальных условий свечения
бактерий в анализируемую пробу вносят навеску NaCl, чтобы ее концентрация в среде составляла 3%, величина рН пробы должна
быть доведена до 7. Для контроля используют 3% раствор NaCl в дистиллированной
воде.
Количество ДО в пробе - 10 % по массе.
3.5.4 Подготовка к выполнению исследования
Характеристика тест-объекта. В качестве тест-объекта
используется лиофилизированная культура светящихся бактерий - Photobacterium
phosphoreum (Conn) Ford или Photobacter Fisheri. Фотобактерии представляют
собой клетки-коккобациллы (1,0-2,5мкм) или палочки (0,4-1,0 мкм) грамм
отрицательные, аспорогенные, встречаются отдельно или в парах. Двигаются при
помощи одного или нескольких полярных жгутиков. Живут в морской воде, на
поверхности тела и в пищеварительном тракте морских рыб, в некоторых органах
головоногих моллюсков. Фотобактерии - факультативные анаэробы, но свечение
происходит только в присутствии кислорода. Бактерии светятся в видимой
голубовато-зеленой области спектра с максимумом 472 нм. Механизм свечения -
активация системы - люциферин-люцифераза. Культивируются в питательных средах,
которые содержат 0,5-5,0% NaCl при рН = 6-9. Оптимальная концентрация NaCl -
3%.
Приготовление суспензии
клеток.
Исходная суспензия: содержимое
флакона (лиофилизированная культура бактерий) суспензируют в 1 см3
2% раствора NaCl, предварительно охлажденного до +5°С, затем разводят до 10 см3
3% раствором NaCl и оставляют в холодильнике на 1 ч. при +5°С. Стабильно до
двух недель (в холодильнике).
Рабочая суспензия:
- 0,5 см3 исходной суспензии разводят до
10 см3 3% раствором NaCl (стабилен в течение рабочего дня);
- суспензию выдерживают при температуре 20±4°С в
течение 45 мин. с целью ее реактивации и стабилизации люминесценции бактерий;
- для сохранения активности суспензию бактерий
помещают в ледяную баню;
- каждую новую партию культуры (а также
непосредственно перед опытом) проверяют на пригодность к биотестированию. Для
этого устанавливают эффективную концентрацию (ЭК50) раствора
эталонного вещества K2Cr2O7.
Из него готовят исходный раствор на 3% растворе NaCl, из которого затем
приготавливают серию разведений от 0,1 до 2,0 мг/дм3. Биотестирование
этих растворов проводят в течение 30 мин. В соответствии с процедурой,
приведенной в пунктах 2.2.3 и 2.2.6. На основании полученных
результатов рассчитывают (или определяют графически) ЭК50 K2Cr2O7.
Если ЭК50 находится в диапазоне 0,5-1,2 мг/дм3 K2Cr2O7,
культура бактерий пригодна для биотестирования (Приложение
В). Если ЭК50, не находится в указанном диапазоне реагирования,
следует использовать другую партию культуры, проверенную вышеуказанным
способом.
В зависимости от чувствительности регистрирующей
аппаратуры процедура анализа может быть модифицирована путем изменения
количества биореагента.
3.5.5 Выполнение исследований
Исследование проводят со стандартной смесью -
песок-ил (1:1), либо с природными ДО любого гранулометрического состава в
зависимости от требований опыта.
Для определения границ токсичности исследуемое
вещество вносят в ДО и готовят серию разведений чистыми ДО (как указано в
подразделе 3.1). Навеску (1 г)
загрязненных (опыт) и чистого (контроль) грунта вносят в пробирки и приливают 9
см3 3% раствора NaCl. Тщательно смешивают.
Из приготовленной рабочей суспензии фотобактерий 0,5
см3 вносят в кювету для измерения и добавляют 0,5 см3
декантата контрольной пробы. Содержимое кюветы (пробирки) перемешивают
встряхиванием и через 30 мин. измеряют интенсивность люминесценции (контроль).
Сигнал должен находиться в пределах 500-1500 mV, если измерения проводят на
люминометре Emilite 1003. Если сигнал выше, рекомендуется развести суспензию 3%
раствором NaCl.
При измерении токсичности загрязненных ДО 0,5 см3
суспензии культуры бактерий смешивают с 0,5 см3 декантата опытных
проб, содержащих определенное количество исследуемого вещества. Фиксируют
момент добавления суспензии с помощью секундомера. Изменения интенсивности
свечения регистрируют через 30 мин. Замеры производят в 3-х параллельных пробах
контроля и каждого варианта опыта.
3.5.6 Учет и оценка результатов
На основании результатов 3-х параллельных
определений в контроле и трех в опыте находят среднее арифметическое
интенсивности люминесценции (I) бактерий. Рассчитывают в условных единицах (а)
или процентах (б) снижение интенсивности люминесценции (Т) по формуле:
a) ![]()
где IК -
интенсивность люминесценции в контроле,
I0 -
интенсивность люминесценции в опытах.
б) ![]()
где Р -
снижение интенсивности люминесценции в %.
Вывод о степени токсичности образца ДО делают на
основании величин Т или Р:
Т=0 образец не токсичен (нет гашения свечения),
Т=0,3 образец с небольшой токсичностью (гашение
свечения до 25%),
Т=0,3-3,0 образец токсичен (гашение свечения от 25
до 75%),
Т=3,0 образец сильно токсичен (гашение свечения
более 75%),
Т=1,0 (50%-ное гашение свечения, ЭК50).
Величины ЭК25; ЭК50 можно
определить графически (см. раздел
4).
3.6
Установление максимально допустимых уровней вещества в донных отложениях по
показателям жизнедеятельности одноклеточных водорослей (Scenedesmus quadricauda
(Turb.) Breb.var.
quadricauda)
3.6.1 Принцип метода
Метод основан на установлении различий интенсивности
размножения зеленых протококковых водорослей Scenedesmus quadricauda в
присутствии нормируемого вещества (опыт) и в контроле.
Критерием токсичности является статистически
достоверное снижение коэффициента прироста численности водорослей в опыте по
сравнению с контролем в остром (семисуточ-ном) и хроническом (28-35-суточном)
опытах. В качестве дополнительных критериев могут использоваться:
фотосинтетическая активность - по изменению содержания хлорофилла и
каротиноидов, О2, а также рН среды, процент гибели клеток
(люминесцентный метод и окраска метиленовым синим или другими витальными
красителями).
3.6.2 Средства измерений, вспомогательные устройства, материалы и
реактивы:
Использованы следующие средства измерения, материалы
и реактивы:
- автоклав, обеспечивающий стерилизацию в течение 60
мин. при давлении в 1 атм.;
- алюминий ванадиевокислый, ГОСТ 9336-75;
- аппарат Зейтца или другой фильтровальный аппарат;
- борная кислота, ГОСТ 9656-75;
- бумага фильтровальная, ГОСТ 12026-76;
- вата медицинская гигроскопическая, ГОСТ
5556-81;
- вода дистиллированная, ГОСТ 6709-72;
- водяная баня, t°C - до 100°С;
- воронки лабораторные, ГОСТ
25336-82;
- дозаторы пипеточные объемом 0,1 и 0,5 см3
П-1, ГОСТ
28311-89;
- калий азотнокислый, ГОСТ 4217-77;
- калий фосфорнокислый однозамещенный, ГОСТ
4198-75;
- калий углекислый, ГОСТ 4221-76;
- кальций азотнокислый, ГОСТ 4142-77;
- камера для счета форменных элементов крови по
Горяеву 0,1 мм глубины;
- колбы конические, вместимостью 1 дм3 и
250 см3, ГОСТ
25336-82;
- колбы мерные на 0,5 и 1,0 дм3, ГОСТ
1770-74;
- магний сернокислый, ГОСТ 4523-77;
- магний хлористый четырехводный, ГОСТ 4209-77;
- марля медицинская, ГОСТ 9412-93;
- микроскоп, с увеличением 3,3-88х;
-оксид молибдена, ГОСТ 14338.3-91;
- плитка электрическая, ГОСТ
14919-83;
- покровные и предметные стекла, ГОСТ 6672;
ГОСТ 9284-75;
- стаканы химические лабораторные объемом 0,5-1,0 дм3,
ГОСТ
25336-82;
- термометр лабораторный, цена наименьшего деления
шкалы °С-0,1, ГОСТ
112-78;
- термооксиметр, 0,0-9,9 мг/дм3 с
погрешностью ±5,0 %;
- цилиндры мерные объемом 100, 250, 500 см3,
ГОСТ
1770-74;
- цинк сернокислый семиводный, ГОСТ 4174-77;
- рН-метр, 0-14 ед. с погрешностью ±0,05 рН.
3.6.3 Условия проведения исследований
В помещении не должно быть вредных испарений и
газов, негативно влияющих на жизнедеятельность Scenedesmus quadricauda.
Оптимальный режим предусматривает культивирование водорослей при температуре
20±2°С в люминостате при сочетании естественного освещения и досвечивания в
течение 12 ч. в сутки с общей освещенностью 3-5 тыс.лк. Колбы с водорослями
размещают в люминостате так, чтобы освещение было равномерным снизу или сверху
при удалении источника от колб на 30-40 см во избежание их перегрева. При
отсутствии температурных условий опыты могут проводиться с размещением колб на
окне при естественном освещении с защитой от прямых солнечных лучей и при
досвечивании лампами дневного света.
Питательную среду Успенского, Тамия, Прата стерилизуют
в автоклаве (0,5 ч. при 1 атм.), а при отсутствии автоклава - кипячением на
медленном огне на водяной бане. Компонентный состав среды включает макро- и
микроэлементы (таблица 3.6).
Таблица 3.6
Состав питательных сред для культивирования водорослей
|
Компоненты |
Содержание в среде, г дм3 |
|||
|
Тамия |
Успенского № 1 |
Прата |
||
|
KNO3 |
5,000 |
0,0250 |
0,100 |
|
|
К2НРО43Н2О |
- |
- |
0,010 |
|
|
КН2РО4 3Н2О |
1,250 |
0,0250 |
- |
|
|
К2СО3 |
- |
0,0345 |
- |
|
|
MgSO4 7H2O |
2,500 |
0,0250 |
0,010 |
|
|
Са(NО3)2 4H2O |
- |
0,1000 |
- |
|
|
FeCl3 6H2O |
- |
- |
0,001 |
|
|
Микроэлементы (1 см3): |
ZnSO4·7Н2О -
2 г/л, СuSО4·5Н2О - 0,079 г/л, NaBO3·4H2O - 2,63 г/л, (NH4)6Мо7O24·4Н2О - 0,08 г/л, FeSO4·7H2O - 9,3 г/л, СаСl2 - 1,2 г/л, Co(NO3)2·H2O - 0,02г/л, ЕDТА-10 г/л |
|||
Удобно
предварительно приготовить основные растворы впрок, а затем из них вносить по
0,5 см3 на 1 дм3 дистиллированной воды; рН после
стабилизации раствора (равномерным кипячением в течение 0,5 ч.) составляет
7,0-7,3. Для приготовления смеси микроэлементов навески указанных выше солей
растворяют в дистиллированной воде, кипятят и доводят до 1 л.
Возможно также приготовление
питательной среды на отстоянной и кипяченной питьевой воде. В этом случае
необходимости в добавлении микроэлементов, как правило, нет. Состав среды может
быть и другим. Важно, чтобы у водорослей был хороший рост и сохранялась чистая
культура.
Колбы стерилизуют в автоклаве (1,5 ч. при 1 атм.)
или сухим жаром в течение 1 ч. при 108°С. Для предотвращения оседания клеток на
дно в культуре и их прикрепления к стенкам, а также для лучшего растворения СО2,
содержимое колб не менее двух раз в сутки перемешивают, либо используют
магнитную мешалку. Объем экспериментальной среды 300-600 см3.
Отношение поверхности к объему - примерно 0,25.
3.6.4 Подготовка к выполнению исследований
Для опытов используется молодая синхронная культура
водоросли Scenedesmus quadricauda. Для ее получения за несколько дней до
постановки опыта небольшое количество плотной водорослевой культуры помещают в
больший объем питательного раствора. Ведут контроль под микроскопом за
динамикой численности молодой культуры, доводя ее до необходимого значения.
Культуру водорослей для заполнения экспериментальных
сосудов приготовляют следующим образом. К одной части молодой синхронной
культуры водоросли (численностью 500 млн. кл./дм3) добавляют 1,5
части питательного раствора и 2,5 части природной или дехлорированной питьевой
воды. Численность клеток в такой взвести будет примерно 100 млн. кл./дм3.
В стаканы помещают подготовленные навески ДО с
внесенным нормируемым веществом в разных концентрациях (см. подраздел
3.1), заливают подготовленной культурой водорослей, стараясь не взмучивать
ДО, и экспонируют. Объем экспериментальной среды 300 см3.
3.6.5 Острые опыты
В остром опыте исследуется широкий диапазон
концентраций, позволяющий охватить по возможности весь спектр реакции вида на
токсикант. Опыты проводятся в смеси ила с песком (1:1) в трехкратной
повторности. Их продолжительность 7 сут. Стандартное содержание ДО в среде 10%
по массе (в пересчете на сухую массу). Поскольку во время опыта следует
избегать перемешивания, отбор для просмотра под микроскопом следует проводить
только в конце острого опыта (на 7 сут.). До этого времени проводятся
визуальные наблюдения за развитием культуры, изменением рН среды и О2,
которые не требуют перемешивания. Перед просмотром культуры под микроскопом
водоросли переводят во взвешенное состояние легким помешиванием стеклянной
палочкой.
3.6.6 Хронические опыты
Хронические опыты проводятся в более узком диапазоне
концентраций с целью определения максимальной недействующей концентрации
токсиканта. Объем экспериментальной среды 600 см3. Длительность
опытов 28-35 сут. Способы внесения тестируемого вещества в ДО, заполнения
экспериментальных сосудов и приготовление культуры водорослей такие же, как в
остром опыте. Для хронических опытов используется синхронная культура водоросли
Scenedesmus quadricauda меньшей плотности, чем в острых опытах. В этом случае
экспоненциальный рост происходит за более длительный период. Например, можно
использовать культуру с численностью 250 млн. кл./дм3. Тоща
начальная численность в экспериментальных сосудах будет 50 млн. кл./дм3.
Возможен вариант хронического эксперимента со сменой
экспериментальной среды каждые 7 дней. В этом случае начальная плотность
синхронной культуры должна быть такой же, как в остром опыте, то есть 500 млн.
кл./дм3. Опыт начинается, как бы, заново, с той лишь разницей, что
культура водорослей для заполнения экспериментальных сосудов готовится из
водорослей соответствующего варианта.
3.6.7 Учет и оценка результатов
В остром опыте учитываются следующие показатели:
- численность водорослей в контроле и опыте;
- измерение рН культуры водорослей и содержания О2;
- характеристика морфологических особенностей клеток
водорослей по результатам наблюдений под микроскопом;
- визуальные наблюдения за состоянием культуры.
Например, степень покрытия поверхности ДО водорослевым зеленым налетом.
Дополнительные тесты:
определение хлорофилла, каротиноидов, гибель клеток.
В ходе хронического эксперимента определяются:
динамика численности клеток в популяции, рН среды и содержание О2,
удельная скорость роста популяции, состояние культуры (визуально) и
характеристика морфологических особенностей клеток водоросли. Дополнительные
тесты: определение хлорофилла и каротиноидов, процент гибели клеток.
Подсчет численности популяции под микроскопом в
камере Горяева проводится каждые 7 суток. При этом возникает необходимость
перевести водоросли, скопившиеся на поверхности грунта, во взвешенное
состояние. Избежать взмучивания илистой фракции полностью не удается, но свести
к минимуму можно, производя эту процедуру легким помешиванием стеклянной
палочкой.
Используя сведения о численности клеток в культуре в
начале и в конце опыта, определяют удельную скорость роста популяции (К) по
формуле:
![]()
где N -
конечная плотность популяции, млн. кл./дм3,
П - начальная плотность
популяции, млн. кл./ дм3,
Т - время экспозиции, сут.
По результатам острого опыта может быть определена медианная
летальная концентрация - ЛК50 (в случае, если вещество оказывало
острое летальное действие на водоросли). Для этого рассчитывается уравнение
линейной регрессии на 95 % доверительном уровне. Зависимой переменной в
уравнении является концентрация вещества, независимой - индекс численности. В
полученное уравнение вида у=ах+в проставляют значение индекса численности,
равное 0,5. Тогда решение уравнения даст значение ЛК50.
Результаты острых и
хронических опытов записываются в рабочую таблицу. Примерная форма записи
указана в таблице 3.7
Таблица 3.7
Форма записи результатов острых и
хронических опытов
|
Результаты острого
(хронического) опыта с водорослью S.quadricauda Время экспозиции, сут. |
Показатель |
Контроль |
Концентрации |
||
|
С1 |
С2 |
……
Сn |
|||
|
1 |
численность млн.
кл./дм3 |
|
|||
|
|
рн |
||||
|
|
О2 |
||||
|
|
морфологические |
||||
|
|
особенности клеток |
||||
|
|
визуальные наблюдения |
||||
|
2, 3…… |
численность млн.
кл./дм3 |
||||
|
7………35 |
|
||||
|
|
рн |
||||
|
|
О2 |
||||
|
|
морфологические |
||||
|
|
особенности клеток |
||||
|
|
визуальные
наблюдения |
||||
Все полученные данные статистически обрабатываются
по стандартным методам (раздел
4). Определяют ЭК0, ЭК25, ЭК50,
графическим методом.
3.7 Установление максимально допустимого уровня вещества в донных
отложениях по показателям жизнедеятельности высших водных растений (Elodea
canadensis Rich, Vallisneria spiralis Linne, Lemna minor Linne).
3.7.1 Принцип метода
Метод основан на установлении
различий между выживаемостью и состоянием Elodea canadensis в опытных пробах
(вода - ДО - нормируемое вещество) и данными показателями в контроле (вода -
ДО).
Критерием острой токсичности является 25% гибель
растений в опыте по сравнению с контролем в 5-10-суточном эксперименте.
Критерием хронической токсичности нормируемого вещества в ДО является
статистически значимое отклонение в опыте от контроля при доверительной
вероятности Р≤0,05 показателей: выживаемость растений и клеток корней,
изменение морфометрических показателей и функциональной активности. В качестве
концентрации при отсутствии статистически достоверной разницы принимается
отклонение от контроля в 25% случаев [11].
Отклонение от контроля по состоянию растений
(изменение окраски, потеря тургора, повреждение точек роста и др.)
устанавливается визуально.
3.7.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- аквариумный микрокомпрессор, объем аэрации 7,2
л/мин.;
- ацетокармин или ацетоорсеин;
- вода дистиллированная, ГОСТ 6709-72;
- воронки лабораторные, ГОСТ
25336-82;
- газ - сито № 68, ГОСТ
4403-91;
- глазной пинцет, лезвие, ГОСТ
21241-89;
- калий азотнокислый, ГОСТ 4217-77;
- калий фосфорнокислый двузамещенный трехводный, ГОСТ
2493-75;
- калий углекислый, ГОСТ 4221-76;
- кальций азотнокислый четырехводный, ГОСТ
4142-77;
- кристаллизаторы объемом 1 дм3 ГОСТ
25336-82;
- круглые аквариумы объемом 10-15 дм3;
- ледяная уксусная кислота, ГОСТ 61-75;
- линейка, ГОСТ 427-75;
- люминостатная установка (для культивирования),
позволяющая поддерживать освещение лампами дневного света 1,5-2 клк.,
температуру окружающего воздуха 22-25°С;
- магний сернокислый семиводный, ГОСТ 4523-77;
- метиленовый синий;
- натрий фосфорнокислый однозамещенный, ГОСТ
245-76;
- пипетки вместимостью 1, 2, 5, 10 см3, ГОСТ
25336-82;
- стаканы стеклянные лабораторные объемом 0,5 дм3,
ГОСТ
25336-82;
- стеклянные палочки, ГОСТ
29227-91, ГОСТ
25336-82;
- термометр лабораторный, цена наименьшего деления
шкалы 0,1°С, ГОСТ
13646-68;
- фильтровальная бумага, ГОСТ 12026-76;
- этиловый спирт, ГОСТ
18300-87;
- рН-метр, 0-14 ед. рН с погрешностью ±0,05 рН.
3.7.3 Условия выполнения исследований
В помещении не должно быть вредных испарений и
газов, негативно влияющих на жизнедеятельность Elodea canadensis.
Экспериментальные сосуды с элодеей располагают у окон на дневном рассеянном
свету (с южной стороны) или в люминостате при освещенности 1,5-2 клк на
протяжении 10-12 часов. В среде поддерживается оптимальная для данного вида
температура от 17 до 22ºС. Объем экспериментальной среды с ДО для 5
растений не менее 1 дм3. В качестве подкормки можно добавлять среду
Успенского № 1.
Показатель рН водной среды - 7,0-7,3. Для
обеспечения хорошей аэрации осуществляют продувку с помощью микрокомпрессора.
3.7.4. Подготовка к выполнению исследований
Подготовку донных отложений осуществляют, как
указано в подразделе 3.1.
Тест-объекты (Lemna minor, Vallisneria spiralis,
Elodea canadensis) культивируют в лабораторных условиях, либо отбирают из
естественных популяций (элодея, ряска) чистого водоема в конце мая - начале
июня, когда появляется много молодых побегов. В течении 10-14 дней растения
акклимируются к лабораторным условиям.
Элодея (Elodea canadensis Rich) -
представитель погруженных растений, широко распространенных в стоячих водоемах
умеренной зоны. Стебли стелются по дну водоема, давая многочисленные
вертикальные побеги, укореняются у основания и несут плавающие корни.
Температурная граница выживаемости в пределах от плюс 5°С до 41,5°С [12].
Валлиснерия (Vallisneria spiralis
Linne) - многолетнее полностью погруженное укореняющееся растение, обитающее
в водоемах южной части России. Используется как аквариумное растение [13].
Ряска (Lemna minor Linne) - водное,
свободноплавающее растение. Вегетативное тело ряски имеет вид листа, или, как
его называют, - щитка или листеца. Средняя длина щитков 4-5 мм. Репродуктивный
потенциал материнского щитка, выраженный количеством дочерних щитков, которое
способно воспроизвести материнская особь, равен в среднем 10. Средняя
продолжительность жизни одного щитка тридцать дней. Цикл размножения относительно
короткий (3-5 дней). Корень располагается перпендикулярно листецу. Ряска весьма
удобна для культивирования, не требовательна к сложным питательным средам [12,
13].
Опыты проводят в дехлорированной питьевой или
природной воде из чистых водоемов. В опытах используют Elodea canadensis,
отобранную из естественной популяции условно чистого водоема в конце мая -
начале июня, когда появляется много молодых, наиболее жизнеспособных растений.
У элодеи отсекают зеленые верхушечные побеги длиной 8-10 см без боковых
отростков и корней, не имеющих видимых повреждений. В течение 7-10 дней
растения проходят акклимацию при комнатной температуре, достаточной
освещенности и при частичной смене воды каждые 3-5 сут. Для лучшего роста в
воду вносят среду Успенского № 1 (см. таблица 3.7),
которая способствует быстрому образованию боковых побегов, увеличению биомассы
растений, а также дает возможность круглогодичного содержания растений,
пригодных для экспериментов.
3.7.5 Острые опыты
Острые опыты (96 ч.) проводятся в кристаллизаторах
объемом 1 дм3 (элодея), аквариумах объемом 3 дм3
(валлиснерия) и чашках Петри (ряска), в 3-х повторностях, в 4-5 разведениях ДО,
различающихся на порядок. В опытные емкости помещают ДО (10% по массе) и
осторожно приливают природную или отстоянную питьевую воду (до определенного
уровня). Через сутки помещают растения (5 экз. на 1 дм3). Для
экспериментов используют верхнюю часть побега элодеи длиной 4 см без боковых
отростков и корней, 1-щитковые колонии ряски и розетки валлиснерии с 4-6
листьями
3.7.6 Хронические опыты
Хронические опыты (30 сут.) с элодеей и валлиснерией
можно проводить в одном аквариуме - объемом 3-5 дм3. Соотношение
ДО-вода - 1:9. Вода природная, либо питьевая - отстоянная и аэрированная. На 1
дм3 воды помещают по 1 растению элодеи и валлиснерии. Последнюю
высаживают в ДО, элодею фиксируют на дне с помощью небольшого камня. Все
растения подбираются одного размера: элодея - 5 см с верхушечной почкой,
валлиснерия - розетки с 4-6 листьями.
Опыты с ряской проводят в чашках Петри с тестируемым
грунтом слоем 0,5 см и водой - 0,5 см. По мере роста корни ряски заглубляются в
грунт. В каждую чашку помещают по 10 однощитковых, одновозрастных колоний
ряски.
Смену воды и ДО в опытных и контрольных вариантах
производят в зависимости от стабильности вещества и скорости накопления
метаболитов.
На 1 дм3 воды с грунтом (10%) помещают по
5 экземпляров растений. Каждые 5 суток учитывают выживаемость и
морфометрические показатели. В начале и в конце эксперимента определяют
биохимические и цитогенетические показатели.
3.7.7 Метод учета живых и мертвых клеток в корнях высших водных растений
В качестве красителя используют раствор метиленового
синего в фосфатном буфере: 200 мг красителя на 1 литр буферного раствора.
Состав фосфатного буфера: в 1 литр дистиллированной воды вносят 27,2 г KH2PO4
и 0,07 г Na2HPO4, pH раствора - 4,6. Следует учитывать,
что у высших растений в корнях имеются проводящие пучки, состоящие из мертвых
клеток. На препаратах данные пучки выглядят как вертикальные одно- двухслойные
ряды темно-синих клеток, которые не учитываются. В ходе эксперимента
регистрируются мертвые одиночные темно-синие клетки, заключенные между не
прокрашенными светлыми живыми клетками. Бледно-голубая окраска клеток, которая
может встречаться на препаратах, свидетельствует об увеличении проницаемости
мембран в результате серьезных нарушений клеток (погибающие клетки).
Для анализа используются фрагменты корешков размером
не более 1 см, которые помещаются в каплю красителя. Окрашивание проводится в
течение 30 мин., затем готовятся временные препараты, которые микроскопируют
при увеличении 8×40.
3.7.8 Учет и оценка результатов
В острых опытах определяют выживаемость растений и
следующие симптомы отравления: угнетение роста побегов и корней, изменение
окраски, потеря тургора, распад на мутовки, отмирание точек роста, отмирание
корней.
Показателями токсичности в хроническом опыте являются:
выживаемость, прирост основного побега и листецов, прирост боковых побегов,
количество боковых побегов, сумма прироста основного и боковых побегов,
суммарный прирост массы всего растения, длина и количество корней, состояние
растений (окраска, тургор и т.д.). Дополнительными показателями являются:
содержание хлорофилла и каротиноидов, рН, О2 биомасса, учет живых и
мертвых клеток.
Прирост основного побега
элодеи определяют в динамике, вычитая исходные 4 см из длины побега к
конкретному сроку, и выражают в сантиметрах, число боковых отростков и корней -
в штуках, суммарный прирост массы всего растения - в граммах. Прирост, число и
длину боковых отростков и корней рассчитывают на одно растение.
Результаты острых и хронических опытов подвергают
статистической обработке по стандартным методикам (раздел
4) и заносятся в таблицы (3.8; 3.9)
Таблица 3.8
Результаты острых экспериментов
|
Время экспозиции, сут. |
Варианты |
Показатели |
|
|
выживаемость, экз. |
симптомы отравления |
||
|
|
К1 |
|
|
|
5 |
К2 |
|
|
|
|
К3 |
|
|
|
|
С1 |
|
|
|
10 |
С2 |
|
|
|
|
С3 |
|
|
Таблица 3.9
Результаты хронического опыта
|
Время
экспозиции, сут. |
Вариант |
Выживаемость,
% |
Показатели |
||||||
|
прирост
основного побега, см |
Кол-во
боковых побегов, шт. |
длина
боковых побегов, см |
Кол-во
корней, шт. |
длина
корней, см |
пересчет
на одно растение |
Суммарный
прирост |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Летальные
ЛК0, ЛК25, ЛК50, ЛК100,
и эффективные концентрации ЛК0, ЛК25, ЛК50,
ЛК100 определяются графически с помощью пробит-анализа (раздел
4).
3.8
Установление максимально допустимого уровня вещества в донных отложениях по
показателям жизнедеятельности инфузорий (Paramecium caudatum Ehrenberg)
3.8.1 Принцип метода
Метод определения
токсичности основан на установлении различий между количеством инфузорий в
опытной пробе (вода-ДО-нормируемое вещество) и контрольной пробе (вода-ДО).
Критериями токсичности
являются показатели статистически достоверного снижения прироста численности
инфузорий в опыте по сравнению с контролем за 24 ч. (острая токсичность) и 96
ч. (хроническая токсичность), а также скорость деления, фагоцитоз и
поведенческие реакции (хемотаксис и фототаксис).
Оценка токсичности
производится путем определения функциональной активности и счета простейших в
динамике с помощью оптической техники.
3.8.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- весы лабораторные 2-го класса точности с наибольшей предельной
нагрузкой 200 г, ГОСТ
24104-88;
- вода дистиллированная, ГОСТ
6709-72;
- вода питьевая, СанПиН 2.1.5.980-00;
- калий двухромовокислый ЧДА, ГОСТ
4220-75;
- калий хлористый ЧДА, ГОСТ 4234-77;
- кальций хлористый двухводный, ГОСТ 4616-69;
- колбы плоскодонные вместимостью 50 см3, ГОСТ
25336-82;
- магний хлористый или сернокислый, ГОСТ 4523-77;
- микроаквариумы из органического стекла, ГОСТ
29136-91;
- микроскоп МБС-10, увеличение 3,5-88х;
- натрий хлористый, ГОСТ
4233-77;
- натрий углекислый однозамещенный или калий углекислый, ГОСТ 4221-76;
- пипетки капиллярные
(пастеровские или глазные с оттянутым носиком) для всех манипуляций с
парамециями;
- пипетки мерные вместимостью 0,1; 1,0 и 5,0 см3
2-го класса точности, ГОСТ
29227-91;
- предметные стекла: обычные и с углублением, ГОСТ 9284-75,
ГОСТ 6672-75;
- пробирки вместимостью 50 см3 для
приготовления рабочих сред, ГОСТ
29227-91, ГОСТ
25336-82;
- пробирки ПП-2-5, ПП-2-10, П-2-15 для ведения
культур парамеций, ГОСТ
1770-74;
- цилиндры мерные вместимостью 5, 10 и 25 см3,
ГОСТ
1770-74;
- часовые стекла диаметром 3-7 см;
- чашки Петри, ГОСТ
25336-82.
3.8.3 Условия выполнения исследований
В качестве тест-объекта
используют лабораторную культуру инфузорий Paramecium caudatum, Ehrenberg 1838 - широко распространенную ресничную
инфузорию, предпочитающую повышенное содержание органического вещества в среде.
Температурный оптимум находится в пределах 24-28°С, рН близкая к нейтральной
(6,5-7,5). Парамеция сочетает признаки клетки и организма, что расширяет
возможности ее использования в эксперименте. Короткий жизненный цикл, высокий
темп деления, возможность клонирования позволяют эффективно использовать ее в
биотестировании и токсикологических исследованиях в течение всего года [3].
Парамеций культивируют на различных средах.
Минеральная среда
Лозина-Лозинского готовится на бидистиллированной воде, в 1 дм3
которой растворяют:
0,1 г - NaCl;
0,01 г - КСl;
0,01 г - СаСl2;
0,01 г - MgCl2;
0,02 г - NaHCO2.
Разливают в колбы на 25-50 см3 и
автоклавируют в течение 30 мин. под давлением 1,5 атм. Пищей для инфузорий
служит смесь чистых культурных дрожжей Sacharomices ellipsodes и бактерий
Bacillus subtilis, культивируемых на сусло-агаре и мясо-пептонном агаре.
Для приготовления питательной взвеси берут по одной
петле дрожжей и бактерий на 25 см3 среды. Через 2-3 сут. стерильной
пипеткой производят подкормку парамеций из расчета 5-7 капель взвеси на 5 см3
культуры. Показателем хорошего состояния культуры является образование
парамециями «кольца» ниже мениска пробирки.
Молочная среда. В чистые
пробирки вносят 10 мл отстоянной кипяченой воды и 2-3 капли снятого молока.
Пробирки закрывают ватными пробками и выдерживают 7 дней при температуре плюс
24-25°С. Готовность среды определяется по наличию бактериальной пленки и
отсутствию пузырьков на дне пробирки. После чего в среду пересаживаются
инфузорий. В среде простейшие питаются молочно-кислыми бактериями, поэтому
имеют белый цвет, что делает их хорошо заметными на темном фоне столика
бинокуляра.
Банановая среда. Кусочки
высушенной на воздухе банановой кожуры размером около 1 см2 помещают
в пробирки с отстоянной кипяченой водой, закрывают ватными пробками и оставляют
на 7-10 сут. при температуре плюс 24-25° С до появления бактериальной пленки и
опускания кожуры на дно пробирки.
Для поддержания стандартных условий культивирования
пользуются культурой в стационарной фазе роста. Для этого пересадку инфузорий и
смену среды необходимо производить при температуре 24°С один раз в неделю, при
12°С и ниже - один раз в две недели. При пересадке культуры 2-3 см3
культуральной среды с большим количеством парамеций из верхней части пробирки
переносят в новую пробирку, со свежей питательной средой (до 5 см3).
3.8.4 Подготовка к выполнению исследований
Подготовленные донные отложения (песок и ил, 1:1)
перед закладкой опыта кипятят в дистиллированной воде в течение 15 мин. Воду
сливают, а ДО раскладывают в чистый лоток и сушат в термостате при температуре
плюс 50-60°С. Высушенные ДО просеивают через сито с диаметром отверстий
0,25-1,0 мм и ссыпают в стеклянные банки с крышками. Готовят ряд загрязненных
ДО, как указано в подразделе 3.1. В качестве контроля
используют подготовленные ДО без тестируемого вещества.
Воду, отстоянную в течение 5-7 дней, кипятят, после
охлаждения аэрируют и используют для приготовления серии ДО с исследуемым
веществом в концентрациях, различающихся в 2-10 раз.
Оптимальная температура для проведения экспериментов
плюс 24-26°С.
3.8.5 Проведение исследования
Для быстрого определения летальных концентраций
вещества в ДО 1 каплю густой культуры парамеций (с предварительно определенным
средним числом клеток) вносят в систему ДО - вода - питательная среда
(соответственно 200 мг - 0,9 см3- 0,9 см3). Используют
исходный образец ДО (с максимальным содержанием исследуемого вещества) и 3 - 4
разведения. Определяют концентрацию, в которой за 0,5 ч. погибло более 50%
парамеций. Ее используют в качестве исходной в остром опыте.
Для острого опыта (24 ч.) в пробирках на 5 см3
готовят ряд разведений (5-6) в трех повторностях. Соотношение твердой и жидкой
фаз 1:9. В каждую из опытных и контрольных систем вносят капилляром по 10
инфузорий. Подсчет численности инфузорий через 24 часа производят с помощью
микроскопа МБС-10. Для этого весь объем жидкой фазы (ЖФ) переносят на
предметное стекло с помощью капилляра (каплями) и просчитывают в них число
парамеций.
Проводят статистическую обработку полученных данных
и определяют ЛК50 - исходную концентрацию для хронического опыта.
Для хронического опыта (4 сут.) готовят серию
разведений (5-6) в 3-х повторностях от концентрации, определенной в остром опыте.
Соотношение ДО и воды 1:9. В каждую пробирку вносят по 10 экз. парамеций. Смену
среды и пересадку 10 инфузорий (после подсчета общего их количества) производят
ежедневно.
3.8.6 Оценка репродукции
Репродукцию изучают методом индивидуальных линий.
Навеску ДО (40 мг) вносят в лунки микроаквариума, приливают 0,2 см3
питательной среды и 0,2 см3 отстоянной кипяченой воды. Инфузорий из
культуры под микроскопом МБС-10 рассаживают по одной в лунки. Исследования
проводятся в 10 повторностях. Микроаквариумы помещают в увлажненные
фильтровальной бумагой чашки Петри. Ежесуточно подсчитывают число парамеций в
каждой лунке. Один экземпляр инфузории переносят в свежеприготовленную взвесь,
остальных инфузорий убирают. Выживаемость определяют по числу выживших линий к
исходному числу (в процентах). Функцию размножения определяют путем подсчета
числа инфузорий в сутки с последующим усреднением данных.
3.8.7 Изучение функциональных характеристик парамеций
Хемотаксис.
Функциональную активность парамеций изучают после окончания острого и
хронического опытов в системах с загрязненным грунтом.
Для регистрации скорости перехода инфузорий из одной
капли в другую в норме проводят наблюдения за парамециями в двух каплях (по 0,1
см3) контрольного раствора, (питательная среда и кипяченая вода 1:1)
соединенными перемычкой. В одну из них помещают 10 инфузорий. Считают число
переходов в течение часа.
Затем на предметное стекло наносят одну контрольную
(питательная среда + вода), вторую - опытную каплю (жидкая фаза опытной
системы), которые соединяют тонкой перемычкой. В каплю контрольного раствора
помещают 10 инфузорий. Наблюдают за скоростью перехода парамеций из контроля в
опыт. Эксперимент проводят в трех повторностях. На 10, 20, 30, 45, 60 минуты
фиксируют количество парамеций в контроле и опыте.
Фототаксис. Половину поля
подсветки бинокуляра закрывают так, чтобы половина капли была затемнена, а
другая освещена. В темную часть капли опыта и контроля вносят по 10 инфузорий.
В течение двух часов через каждые 30 мин. фиксируют количество парамеций в
каждой половине капли. Через определенные промежутки времени (при
необходимости) добавляют растворы, ввиду испарения жидкости. Эксперимент
проводится в 3 повторностях.
Фагоцитоз. Функцию
питания определяют по скорости фагоцитоза. Выживших инфузорий помещают в
часовые стекла с ЖФ контрольного и опытного вариантов, в которые добавляют
каплю суспензии туши, приготовленной на среде Лозина-Лозинского. Через 15 мин.
их фиксируют 4% формалином и под микроскопом подсчитывают число пищеварительных
вакуолей с тушью.
Определение фагоцитоза в динамике. Интактных
инфузорий помещают в контрольную и опытную среды (ЖФ из систем с ДО со взвесью
туши) в бюксы и отбирают по 10-15 особей через 15, 30, 60, 120, 240 мин.,
фиксируют формалином и подсчитывают число пищеварительных вакуолей.
Эксперименты проводятся в 2-3 повторностях.
3.8.8 Обработка и оценка результатов
На основе данных по численности простейших
рассчитывается:
а) коэффициент прироста численности (Кп)
![]()
где Nt
- численность инфузорий через учитываемый промежуток времени,
N0 - исходная
численность инфузорий.
![]()
где NA
- численность простейших в предыдущие сутки,
NB - численность
простейших в последующие сутки,
б) индекс численности (J):
![]()
где N0
- количество инфузорий в опыте,
NK - количество
инфузорий в контроле,
в) интенсивность деления (G):
![]()
где t
- интервал времени (час или сутки),
А - число инфузорий в
предыдущие сутки (час),
В - число инфузорий в
последующие сутки (час).
Вывод о наличии или
отсутствии токсичности проб делают на основании установления статистически
достоверного снижения численности и коэффициента прироста численности инфузорий
в опыте по сравнению с контролем за 24 или 96 ч. Для этого полученные данные обрабатывают
методом вариационной статистики (раздел
4).
Для количественной оценки токсичности вещества
устанавливают: острые летальные концентрации, в которых гибнет 50 % и более
особей за 0,5 ч. и 24 ч; хронические летальные концентрации, вызывающие гибель
всех или части организмов в течение 4 сут.; сублетальные (эффективные)
концентрации (ЕС), не вызывающие гибели организмов в данных условиях, но
снижающие уровень клеточного деления и изменяющие функциональные показатели
жизнедеятельности инфузорий по сравнению с контролем, пороговые концентрации
(минимально действующие) и максимально допустимые уровни (МДУ).
3.9 Установление максимально допустимого уровня вещества в донных
отложениях по показателям жизнедеятельности ракообразных (Daphnia magna Straus)
3.9.1 Принцип метода
Метод основан на установлении различий между
количеством погибших дафний и показателями их жизнедеятельности в опытных
пробах ДО (с разной концентрацией нормируемого вещества) и в контроле (вода -
ДО).
Опыты могут проводиться в двух вариантах:
I вариант: в опытных и контрольных емкостях с ДО и
водой находятся дафнии;
II вариант: в опытных и контрольных емкостях с ДО и
водой находятся дафнии, а также хирономиды или олигохеты для оценки
интенсификации десорбции исследуемого вещества организмами бентоса.
Критерием острой токсичности является гибель 50% и
более дафний в опыте по сравнению с контролем за 96 ч. Критерием хронической
токсичности является выживаемость дафний, изменение сроков появления первой
молоди, снижение общей плодовитости, изменение линейных размеров и темпа роста
рачков к 30 сут. в опыте по сравнению с контролем (при доверительной
вероятности Р<0,05).
В конце опыта контролируется выживаемость организмов
бентоса, которые используются с целью изучения их участия в десорбции
загрязненного вещества, а также ответной реакции на загрязнение ДО.
3.9.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- аквариумный микрокомпрессор, объем аэрации 7
л/мин.;
- бокс для культивирования дафний (освещение -
500-1000 лк, температура плюс 20±2°С);
- бокс для культивирования
водорослей (освещение 3-4 тыс. лк, температура плюс 24±2°С);
- бумага фильтровальная, ГОСТ 12026-76;
- весы лабораторные, 2 класса точности, с наибольшей
предельной нагрузкой 200 г, ГОСТ 24104-88;
- дрожжи хлебопекарные, ГОСТ 171-81;
- железа хлорид, ГОСТ
4147-74;
- калий азотнокислый, ГОСТ 4217-77;
- калий фосфорнокислый однозамещенный, ГОСТ
4198-75;
- колбы конические 250 см3 - 1 дм3,
ГОСТ
25336-82;
- колбы мерные, вместимостью 0,5 и 1,0 дм3
2 класса точности, ГОСТ
1770-74;
- магний сернокислый, ГОСТ 4523-77;
- микроскоп МБС-10, увеличение 3.5-88х;
- оксиметр любого типа, с погрешностью измерения не
более 0,5 мг О2/дм3;
- пипетки мерные объемом 1-10 см3, ГОСТ
29227-91;
- стеклянные кристаллизаторы на 1000 см3;
- термометр с ценой деления шкалы 1°С, ГОСТ
112-78;
- цилиндры мерные, 2 класса точности от 100 см3
до 1 дм3, ГОСТ
1770-74.
3.9.3 Условия выполнения исследований
Исследования проводят в помещении без вредных
испарений и газов, при рассеянном свете, при продолжительности светового
периода 16±1 ч., температуре среды плюс 20±2°С и концентрации кислорода не
менее 6 мг/дм3.
Результаты учитывают, если в конце опыта количество
погибших дафний в контроле не превышало 10% и ЛК50 за 24 ч.
эталонного вещества K2Cr2O7 для культуры
дафний находилась в диапазоне 0,9-2,5 мг/дм3. В противном случае
проверяют условия культивирования тест-объекта, чтобы выяснить причины
ухудшения состояния культуры, или работают со свежей культурой.
3.9.4 Подготовка к выполнению исследований
В качестве тест-объекта используют лабораторную
культуру дафний - Daphnia magna Straus (Cladocera, Crustacea).
В природе в летнее время, а в лаборатории (при
оптимальных условиях культивирования) круглый год дафнии размножаются
партеногенетически. При резком изменении условий существования в культуре
появляются самцы. Период созревания рачков при оптимальной температуре и
хорошем питании 5-8 сут., длительность эмбрионального развития 3-4 сут.
Культуру дафний выращивают в стеклянной посуде,
которую размещают в помещении без вредных испарений и газов. В помещении, где
находятся дафнии, не проводят обработку инсектицидами, не хранят летучих
веществ и не работают с ними. Для мытья посуды, в которой культивируются дафнии
и проводятся опыты, нельзя применять синтетические моющие средства и
органические растворители.
Оптимальная температура для культивирования дафний
составляет плюс 20°±2°С, продолжительность светового периода (16±1), темного -
8±1) часа. Не допускается освещение дафний прямыми солнечными лучами.
Оптимальное для жизнедеятельности дафний содержание растворенного в воде
кислорода 6-7 мг/дм3. Дафнии довольно устойчивы к колебаниям
кислородного режима.
Для культивирования дафний используют
культивационную среду, т.е. питьевую воду, дехлорированную путем отстаивания не
менее 10-14 сут. в присутствии высшей водной растительности в бутыли из
бесцветного стекла. Начальная плотность культуры дафний 10-15 особей в 1 дм3.
Воду аквариумов обновляют наполовину один раз в 7-10 сут. Пересаживают дафний
при помощи стеклянных трубок диаметром 5-7 мм так, чтобы их не травмировать.
Для этого конец трубки помещают в толщу воды и держат до тех пор, пока дафнии
не перейдут в воду. Аэрировать воду в посуде с дафниями не рекомендуется.
Дафний кормят один раз в сутки суспензией зеленых водорослей и 1 раз в неделю -
суспензией хлебопекарных дрожжей. Для приготовления дрожжевого корма 1 г свежих
или 0,5 г воздушно-сухих дрожжей заливают 100 см3 дистиллированной
воды. После набухания дрожжей суспензию тщательно перемешивают и отстаивают в
течение 30 мин. Надосадочную жидкость используют для кормления дафний из
расчета 5 см3 на 1 дм3 воды. В качестве водорослевого
корма для дафний рекомендуется использовать зеленые протококковые водоросли -
сценедесмус или хлореллу. Их вносят в емкость с дафнями из расчета 1 см3
суспензии (6-7 млн. кл./см3) на 1 дм3 воды.
Для токсикологических опытов по регламентации
веществ в ДО используют рачков однодневного возраста из смешанной культуры
дафний. В опытах при совместном содержании дафний и бентосных организмов
используется лабораторная культура Chironomus dorsalis или личинки хирономид,
отобранные в чистом водоеме (Ch. dorsalis, Ch. thummi, Ch. plumosus). Методика
проведения опытов описана в подразделе 3.13.
3.9.5 Проведение исследований
Готовят серию разведений ДО с исследуемым веществом,
раскладывают их в кристаллизаторы объемом 500 см3 и заливают
дехлорированной питьевой водой в соотношении 1:4 с целью локализации дафний в
придонном слое воды. Опыты проводят в трех повторностях. В контроль вносят
чистый грунт. Продолжительность опыта - 30 сут. Концентрации нормируемого
вещества определяют исходя из опытов с организмами бентоса (см. 3.11
и 3.13).
Опыты проводят в 2-х вариантах:
- в I варианте используют только дафний - по 20
односуточных рачков в каждой повторности опыта и контроля;
- во II варианте - по 20 хирономид или олигохет и по
20 дафний в каждой повторности опыта и контроля.
При проведении хронических опытов (I вариант) один
раз в неделю вносят одноклеточные водоросли Scenedesmus quadricauda или Chlorella
vulgaris из расчета 1 мл суспензии на 1 л воды. Во II варианте опытов 1 раз в
неделю вносят сухие белковые дрожжи (30-40 г/м2 дна) в качестве
корма для дафний и хирономид.
3.9.6 Учет и оценка результатов
Учет и оценка результатов опыта с дафниями осуществляют
так же, как при установлении ПДК веществ в воде водных объектов [3].
Учет данных по оценке состояния дафний производится
каждые 10 сут., по хирономидам - в начале и конце опыта. Линейные размеры
дафний определяются под микроскопом МБС - 10 с помощью окуляр-микрометра и
переводятся в мм. Темп роста рассчитывается по формуле
![]()
где l1 - линейные размеры рачков
предыдущего учета (мм),
l2 - линейные
размеры в последующий учетный период (мм),
t - время (сут).
При наблюдении за размножением рачков учитывают
время рождения первой молоди, количество Народившейся молоди в опыте и в
контроле. Удаление молоди производится каждые 10 сут.
При учете результатов опытов с хирономидами
регистрируются следующие показатели:
- основные - выживаемость личинок, куколок, имаго,
сроки и количество вылетевших комаров, в процентах, количество уродливых
особей, в процентах;
- дополнительные - внешний вид, окраска личинок,
поведенческие реакции, внешний вид и активность имаго.
Данные подвергаются статистической обработке (раздел
4), ЛК50, определяют экспериментально или графически на 10 и 30
сут.
Формы записи хронического эксперимента представлены
в таблицах 3.10 и 3.11
Таблица 3.10
Результаты хронического эксперимента на дафниях ![]() ± m
± m![]()
|
Время экспозиции, сут. |
Концентрации, г/кг |
Выживаемость, % |
Количество молоди, шт. |
Линейные размеры, мм |
Темп роста, мм/сут. |
|
0 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
20 |
|
|
|
|
|
|
30 |
|
|
|
|
|
Таблица
3.11
Результаты хронического эксперимента на хирономидах ![]()
|
Время экспозиции, сут. |
Концентрации, г/кг |
Гибель личинок, % |
Гибель куколок, % |
Гибель имаго, % |
Вылет комаров, сут. |
|
0 |
|
|
|
|
|
|
30 |
|
|
|
|
|
3.10
Установление максимально допустимого уровня вещества в донных отложениях по
показателям жизнедеятельности водяного ослика (Asellus aquaticus linne)
3.10.1 Принцип метода
Состояние организмов контролируется в остром опыте
по выживаемости и поведенческим реакциям, в хроническом - по выживаемости,
поведенческим реакциям, росту и степени поедания корма.
Критерием токсичности является статистически значимое
отклонение от контроля по выживаемости, а также степени поедания корма и росту
опытных рачков при доверительной вероятности Р ≥ 0,95. Отклонение от
контроля на 25% рассматривается как выраженная тенденция отличия (пороговый
уровень). Отклонение от контроля по поведенческим реакциям устанавливается
визуально.
3.10.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- весы аналитические, ГОСТ 24104-88;
- весы технические ВЛКТ-500-М, 4-го класса точности,
ГОСТ
24104-88;
- весы торсионные ВТ-500, цена деления 1 мг,
градуированы при температуре 20°С;
- дночерпатель Петерсена или другой конструкции,
0,025 м2, 0,01 м2;
- кристаллизаторы диаметром от 19 до 25 см, ГОСТ
25336-82;
- лотки площадью от 0,25 м2 и больше для
адаптации и культуры рачков;
- мерные цилиндры емкостью 500 мл и 1000 мл 2-го
класса точности, ГОСТ
1770-74;
- мельничный газ, ГОСТ
4403-91;
- микропипетка, ГОСТ
29227-91;
- осветительные лампы, ГОСТ 6825-91;
- термометры с ценой деления шкалы 0,5°С, ГОСТ
112-78;
- фильтровальная бумага, ГОСТ 12026-76.
3.10.3 Условия проведения исследований
При проведении токсикометрических экспериментов с
водяным осликом поддерживается оптимальная для данного вида температура от 17
до 22°С. В помещении не должно быть вредных испарений и газов, негативно
влияющих на жизнедеятельность рачков. Экспериментальные сосуды в дневное время
равномерно освещаются люминесцентными лампами светом малой интенсивности 70-100
люкс. Объем экспериментальной среды с ДО для 10 подопытных организмов должен
быть не менее 500 дм3. Для обеспечения хорошей аэрации отношение
поверхности грунта к объему экспериментальной среды составляет примерно 0,6.
Для экспериментов используется пресная природная вода из чистого водоема.
Проведение экспериментов с водяным осликом возможно
лишь при наличии природного источника этих организмов, так как круглогодичная
культура данного вида в лаборатории затруднена.
Пригодность культуры рачков
для проведения токсико-метрических экспериментов контролируется по выживаемости
в контроле, которая должна быть в хроническом опыте не ниже 85%.
3.10.4 Подготовка к выполнению исследований
До начала экспериментов готовят стандартный грунт -
ил и песок (1:1), как указано в подразделе 3.1.
Следует создать запас опавших побуревших листьев
ольхи, которые удобно использовать в качестве корма во время экспериментов и
для поддержания культуры рачков. Листья собирают в прибрежной зоне водоема и
высушивают на воздухе. Хранят подготовленный корм в мешочках, коробках или
банках. Перед употреблением сухие листья размачивают в течение суток.
Природная вода для поддержания культуры рачков и
экспериментов доставляется в лабораторию по мере необходимости непосредственно
перед ее использованием.
Для опытов используют водяных осликов, отловленных в
водоеме и акклимированных к лабораторным условиям в течение 5-7 дней. Водяного
ослика отлавливают в прибрежье в биотопе опавших листьев или зарослях высшей
водной растительности (например, элодеи) сачком, смывая в эмалированную посуду
широкого диаметра. Собранные рачки сортируются по размерам и помещаются в
аквариум или другие емкости. Самки с марсупиальными сумками помещаются
отдельно.
Для экспериментов, проводимых в летнее время,
организмы отлавливаются и акклимируются по мере необходимости, непосредственно
перед постановкой опыта. Для зимних опытов можно создать запас организмов в
лаборатории. Для этого водяные ослики отлавливаются в начале осени и помещаются
в лотки большой площади. Удобно использовать невысокие деревянные ящики,
устланные полиэтиленовой пленкой. В ящике размером 70×50 см удается
сохранить около 70 организмов в течение зимы. Слой воды в лотках 5-6 см. Убыль
воды за счет испарения необходимо пополнять. Возможна также частичная смена
воды в лотках. Водяных осликов следует подкармливать листовым опадом и водной
растительностью. Корм добавляют по мере его выедания.
Опыты при наличии запаса организмов в лаборатории
могут проводиться в любое время года, хотя предпочтительным является период с
мая по октябрь, когда они активно развиваются в природе. Для опытов
используется средневозрастная группа организмов размером 4-7 мм. Для каждой
серии экспериментов подбираются особи одинаковых размеров. Особи предельных
размеров в опытах использовать не следует из-за повышенной естественной
смертности.
3.10.5 Острые опыты
В остром опыте (7 сут.) исследуется широкий диапазон
концентраций вещества в донных отложениях (см. подраздел 3.1).
Приготовленные образцы ДО помещают в экспериментальные
сосуды (кристаллизаторы диаметром 19 см) из расчета 10-20% по массе на
экспериментальную среду. Навески заливают природной водой. Через сутки в
системы помещают по 10 рачков. Повторность - трехкратная.
В опытах определяют выживаемость и отмечают симптомы
отравления (изменение скорости движения, беспорядочное движение, нарушение
координации, переворачивание на спину, изменение окраски и т.д.).
По данным острых опытов выбирают диапазон
концентраций токсиканта для хронических экспериментов.
3.10.6 Хронические опыты
Для хронических опытов составляется ряд концентраций
(5-7), начиная с той, в которой в остром опыте к 7 сут. достоверно отличие от
контроля по выживаемости. Диаметр кристаллизаторов 23-25 см, объем
экспериментальной среды 2 дм3. В каждый сосуд помещают по 10 рачков
1,0-1,5 мм (в три повторности). Добавление корма в сосуды производят в день
постановки опыта или в течение 2-3 дней после начала эксперимента.
Показателями токсичности в хроническом опыте
являются уменьшение выживаемости, изменения длины организмов, их массы и
потребления корма по сравнению с контролем. Наблюдения проводят каждые 7 дней.
3.10.7 Учет и оценка результатов
Прибавка массы организмов устанавливается по
разности между конечной и начальной массой особей. Взвешивание осликов производится
при помощи торзионных весов на небольшом сите из мельничного газа с точностью
0,5 мг. Перед взвешиванием животных обсушивают на фильтровальной бумаге.
Удельная прибавка (Муд) массы рассчитывается по следующей формуле
![]()
где Мнач
- средняя масса одной особи в начале опыта,
Мкон - средняя
масса одной особи в конце опыта.
Суммарное потребление корма определяют по убыли его
массы. В качестве корма используют опавшие листья ольхи. Перед взвешиванием
лист подсушивают фильтровальной бумагой до тех пор, пока на ней не перестает
появляться влажное пятно. Взвешивание осуществляют на торзионных весах с
точностью до 0,5 мг. Удельное потребление корма (Kуд) рассчитывают по формуле
![]()
где К-
суммарное потребление корма всеми особями за расчетный период,
n - средневзвешенная масса водяных осликов за
расчетный период.
Измерение длины осликов производят под бинокуляром
или лупой на миллиметровой бумаге с точностью 0,5 мм.
Максимально допустимой для водяных осликов
концентрацией тестируемого вещества в ДО считается концентрация, при которой ни
по одному из наблюдаемых параметров не обнаружено статистически достоверных
отличий от контроля.
Статобработка полученных результатов производится,
как указано в разделе
4.
Результаты экспериментов фиксируются в журнале.
Форма записи представлена в таблице 3.12
Таблица
3.12
Результаты хронических экспериментов с водяным осликом
|
Время экспозиции, сут. |
Вариант |
Количество выживших
особей, экз. |
Удельное потребление
корма, г |
Удельный прирост массы
водяных осликов, мг |
Удельный прирост длины
водяных осликов, мм |
|
1 |
|
|
|
|
|
|
35 |
|
|
|
|
|
|
|
|
|
|
|
|
3.11 Установление максимально допустимого уровня вещества в донных
отложениях по показателям жизнедеятельности амфиподы (Hyalella azteca Saussure)
3.11.1 Принцип метода
Метод определения токсичности вещества в ДО основан
на оценке изменений выживаемости, плодовитости, линейных размеров и массы тела
амфиподы Hyalella azteca при воздействии нормируемого вещества, содержащегося в
ДО по сравнению с контролем.
Критерием острого токсического действия является
гибель 50% и более амфипод за период времени до 96 ч. в донных отложениях с
нормируемым веществом (опыт) по сравнению с контролем.
Критерием хронической токсичности является достоверная
по сравнению с контролем гибель рачков, изменение плодовитости, линейных
размеров и массы животных, а также поедаемость корма.
3.11.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- банки стеклянные или полиэтиленовые для отбора и
хранения проб емкостью 50-200см3;
- высушенные листья;
- микроскоп бинокулярный стереоскопический (МБС-9,
МБС-10), увеличение 3.5-88х;
- микрокомпрессор объем аэрации 7,2 л/мин.;
- оксиметр ИЛ-115 с погрешностью ±5,0% (или
аналоги);
- сачок и сито, ГОСТ
4403-91;
- стеклянные сосуды емкостью 1,0 дм3, ГОСТ
25336-82;
- рН-метр, 0-14 ед. рН с погрешностью ±0,05 рН.
3.11.3 Условия выполнения исследований
Опыты проводят в помещении, не содержащем вредных
паров и газов при рассеянном свете с естественной сменой дня и ночи, содержанием
кислорода в воде не менее 5 мг/дм3, температурой воды 20±4°С. Объем
пробы для определения токсичности должен быть не менее 100 см3.
3.11.4 Подготовка к выполнению исследований
Характеристика тест-объекта. Hyalella azteca
характеризуется следующими особенностями: простота культивирования в
лабораторных условиях, относительно высокая чувствительность к загрязняющим
веществам, ассоциированным с донными отложениями, непосредственный контакт с
грунтом и толерантность к физико-химическим характеристикам грунта. Hyalella
azteca обитает в чистых прудах, озерах и прибрежных зарослях высшей водной
растительности [13].
В лабораторных условиях культуру амфипод поддерживают в непроточных (50 дм3)
аквариумах с пресной водой при температуре 22-25°С и рН воды 7,8-8,0, с
содержанием кальция 40 мг/л и продолжительностью светового дня 16 ч. Воду
обновляют на 1/3 один раз в неделю. В качестве субстрата используют аквариумные
растения. Кормят чаще всего березовыми и кленовыми листьями, высушенными при
температуре 80°С. Сухие листья предварительно замачивают в воде в течение 30
дней для удаления таниновых кислот, затем промывают чистой водой в течение 1 ч.
Новые листья добавляют по мере выедания. В случае отсутствия заготовленных:
листьев животных можно кормить сухими шкурками бананов.
Для опытов выращивают синхронизированную культуру
амфипод. Для этого в отдельный аквариум отсаживают 20 самок с выводковыми
камерами с зародышами приблизительно в одной стадии развития. Взрослые самки
способны производить до 50 новорожденных. При каждом спаривании самка линяет и
освобождается от молодого помета из предыдущего спаривания. Новорожденных
особей в возрасте 1-3 дня отбирают для опытов 2 раза в неделю. Амфипод изолируют
при помощи перенесения части листовой подстилки из аквариума с культурой. Такая
подстилка помещается на сито с 5 мм ячеей в поддон, содержащий около 2 см воды.
Животных промывают через сито для того, чтобы отобрать особей размером не более
3 мм. До начала работы рачков содержат в течение суток в аквариумах емкостью 1
л с чистой водой и слабой аэрацией.
3.11.5 Проведение исследований
За сутки до начала опыта готовят серию разведений из
исходного грунта (заиленный песок) с большой концентрацией исследуемого
вещества (см. подраздел 3.1). По 100 г
подготовленных фунтов (опыт) и чистого грунта (контроль) помещают в стаканы и
доливают дехлорированной питьевой водой до отметки 1 дм3. На
следующий день в стакан вносят по 20 амфипод до 3 мм длиной. Проводят острые
опыты в течение 96 ч. в 3 повторностях. Определяют выживаемость рачков, а также
учитывают их поведенческие реакции. По результатам острого опыта определяют
диапазон концентраций вещества в ДО для проведения хронического опыта.
Хроническое токсическое действие донных отложений
определяют после 14-28-суточной экспозиции. Корм вносят каждый третий день из
расчета 0,1 см3 суспензии высушенных листьев на 250 см3
воды. Опыты проводят в трех повторностях.
Критерием хронической
токсичности является гибель, а также достоверное по сравнению с контролем
изменение линейных размеров массы животных и количества новорожденной молоди.
3.11.6 Учет и оценка результатов
Вывод о наличии токсичности анализируемой пробы
делают на основании данных о величине тест-параметра. Проба оценивается как
обладающая острой токсичностью, если за 96 часов в ней гибнет 50% и более
амфипод по сравнению с контролем. Гибель рачков отмечают по наступлению неподвижности:
амфиподы лежат на поверхности грунта, плавательные движения отсутствуют и не
возобновляются при прикосновении пипеткой. Иммобилизованных амфипод
просматривают под бинокуляром для установления симптомов гибели.
Длину тела амфипод измеряют под бинокуляром от
основания 1 антенны до конца третьей уроподы конечности последнего брюшного
сегмента вдоль дорзальной поверхности. Массу тела определяют на торзионных
весах.
Учитывают число спаривающихся особей и количество
молоди.
Полученные данные подвергают статистической
обработке (см. подраздел
4) и определяют графически ЛК50, ЛК0, ЕК50
и ЕК0, на 4 и 28 сут. По полученным величинам для всех
тест-параметров определяют максимально допустимый уровень вещества для данного
тест-объекта.
3.12
Установление максимально допустимого уровня вещества в донных отложениях по показателям
жизнедеятельности брюхоногих моллюсков (Limnaea stagnalis Linne, Planorbarius
sp. Muller,
Planorbis planorbis Iinne, Physa fontinalis Linne)
3.12.1 Принцип метода
Метод определения токсичности вещества в ДО основан
на оценке изменения состояния брюхоногих моллюсков в остром опыте по
выживаемости и поведенческим реакциям, в хроническом - по выживаемости,
поведенческим реакциям, степени поедания корма, изменении массы и размеров
тела, показателям потенциальной и реальной плодовитости, дыханию, показателям
водно-солевого обмена по сравнению с контролем. В качестве дополнительного
теста можно определять каротиноиды в тканях (тело, гепатопанкреас) моллюсков
как биохимический маркер интоксикации [14].
Критерием токсичности действия нормируемого вещества
в ДО на моллюсков является статистически значимое отклонение показателей их
жизнедеятельности от контроля при доверительной вероятности Р<0,05.
Отклонение от контроля на уровне 25% при отсутствии статистической
достоверности характеризуется как четко выраженная тенденция изменения
(пороговая концентрация).
Отклонение от контроля по поведенческим реакциям
устанавливается визуально. К таким реакциям могут быть отнесены: изменение
движения моллюсков по поверхности грунта, выползание из сосудов, нахождение в
толще воды и др.
3.12.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- бинокуляр МБС-10, увеличение 3.5-88х;
- весы аналитические, ГОСТ 24104-88;
- весы технические ВЛКТ-500-М, 4-го класса точности,
ГОСТ
24104-88;
- колбы мерные объемом 0,2-1 дм3, ГОСТ
1770-74;
- кристаллизаторы диаметром от 19 до 25 см, ГОСТ
25336-82;
- лупа складная, ГОСТ
25706-83;
- мерные цилиндры емкостью 500 см3 и 1000
см3, 2-го класса точности, ГОСТ
1770-74;
- микроскоп биологический - МБС-1, МБС-2, увеличение
3-88х;
- муфельная печь на 450ºС;
- ножницы, пинцеты, ГОСТ
21241-89;
- пипетки химические объемом 1-10 см3, 2
кл. точности, ГОСТ
29227-91;
- реактивы для определения кислорода;
- респирометры (цилиндры по 0,5 дм3 с
притертыми стеклами);
- сачки диаметром 0,5-1 см, ГОСТ
4403-91.
- сифоны с зажимами Мора;
- склянки с притертыми пробками на 0,5-1 л для
растворов;
- стаканы химические на 100-500 см3, ГОСТ
25336-82;
- стаканчики для взвешивания (бюксы) диаметром 30-40
мм, ГОСТ
25336-82;
- сушильный шкаф, с температурой до 150ºС с
точностью до ±1ºС;
- термостат на 150ºС с точностью до
±0,5ºС;
- тигли, ГОСТ
19908-90;
- фильтровальная бумага, ГОСТ 12026-76;
- часовые стекла от 3 до 5-7 см;
- чашки Петри, ГОСТ
25336-82;
- штангенциркуль, ГОСТ 166-89;
3.12.3 Условия проведения исследований
В качестве объекта исследований используют прудовика
обыкновенного - Limnaea stagnalis, а также других брюхоногих моллюсков.
При проведении опытов с моллюсками в
экспериментальной среде поддерживается оптимальная температура для данных видов
- плюс 20±2°С. В помещении не должно быть вредных испарений и газов, негативно
влияющих на жизнедеятельность моллюсков. Экспериментальные сосуды в дневное
время равномерно освещаются люминесцентными лампами светом малой интенсивности
(70-100 лк). Грунт для опытов (песок, ил) отбирается на литорали
незагрязненного водоема или водотока.
Для экспериментов используется пресная природная
вода из незагрязненного водоема, либо отстоянная, дехлорированная, аэрированная
питьевая вода, по химическому составу соответствующая требованиям СанПиН
2.1.4.559-96.
Проведение экспериментов с лимнеидами возможно при
наличии природного источника этих организмов, так как круглогодичное
поддержание культуры данного вида, в лаборатории затруднено. Планорбиды и физы
нормально развиваются и дают потомство в аквариумах круглый год. В
экспериментах используют акклимированных в течение 15 дней к лабораторным
условиям молодых особей лимнеид, отловленных в водоемах, проверенных на
зараженность паразитами.
Пригодность культуры моллюсков контролируется по
выживаемости в контроле. При гибели в контроле более 20% особей, опыт следует
повторить с новой партией моллюсков.
3.12.4 Подготовка к выполнению исследований
Питьевую воду отстаивают в течение 7-14 сут. и
аэрируют. Контролируют химический состав и содержание токсикантов. При
использовании природной воды, она должна быть отобрана из чистого водоема и
профильтрована через фильтр с размером пор 3,5 мкм. Культивационная вода должна
удовлетворять следующим требованиям:
- по химическому составу соответствовать
рыбохозяйственных требованиям;
- не содержать органических загрязняющих веществ,
остаточного хлора, токсических веществ;
- рН 6,5-8,5;
- концентрация растворенного кислорода - не менее 5
мг/дм3.
При необходимости вода пропускается через песчано-гравийный
фильтр с активированным углем.
До начала экспериментов подготавливают грунт, как
указано в подразделе 3.1.
Лимней собирают в летние месяцы на мелководье водоемов
в зарослях водной растительности. Отбирают особей приблизительно одинаковых
размеров, одинакового цвета раковины и помещают в кристаллизаторы вместимостью
1-5 дм3 для акклимации к лабораторным условиям в течение двух
недель. Моллюски содержатся в природной воде. Постепенно к природной воде
добавляют отстоянную питьевую воду. В качестве корма используют листья
одуванчиков, капусты, салата, клена. Опыты с лимнеями проводятся в период с мая
по октябрь, когда моллюски активно развиваются в природе, с планорбидами,
физами - круглый год.
3.12.5 Острые опыты
Для острых опытов
используется средневозрастная половозрелая группа организмов. Для каждой серии
подбираются особи одинаковых размеров, формы и цвета раковины. Готовят 5-6
разведений ДО в 3 повторностях, различающихся по содержанию нормируемого
вещества в 10 раз. Приготовленные образцы донных отложений помещают в
кристаллизаторы (1,5-2,5 дм3) и заливают водой из расчета 1 часть
грунта на 9 частей воды. Контролем служат ДО без нормируемого вещества и вода.
Через сутки в кристаллизаторы помещают моллюсков.
В опытные и контрольные
емкости помещают по 4-5 моллюсков. Длительность острого опыта 4-5 сут. Смену
грунта не производят. Моллюсков не кормят. Учитывают следующие показатели: выживаемость
(гибель), поведенческие реакции (выползание из кристаллизаторов, втягивание
ноги, реакции на раздражение, нарушение координации движения), выделение слизи,
гидратация тела (отек). Наблюдения за моллюсками в первые 8 ч. ведут ежечасно,
в дальнейшем 2-3 раза в течение рабочего дня. Критерием гибели животных
является отсутствие реакции ноги на раздражение или выпадение тела из раковины.
3.12.6 Хронические опыты
Для опытов составляется ряд концентраций, начиная с
концентрации, в которой за 96-120 ч. отмечались достоверные отличия от контроля
по выживаемости. Число исследуемых концентраций в опыте 5-6. Эксперимент
проводят в 3-х повторностях по 8-10 моллюсков в каждом аквариуме. Для
хронических опытов используют кристаллизаторы или аквариумы емкостью 5-10 дм3.
Содержание грунта в воде 10% (отношение 1:9).Экспозиция опыта 45-60 сут.
Частичную смену воды (30-50%) производят 1 раз в 10 дней, грунта - в
зависимости от стабильности тестируемого вещества. Концентрацию вещества в
грунтах и воде определяют в начале и конце опыта, а также при смене грунта и
воды. Моллюсков кормят ежедневно.
3.12.7 Учет и оценка результатов
Данные подвергаются статистической обработке (раздел
4).
Результатом 5-суточного эксперимента является
установление концентрации тестируемого вещества в донных отложениях, вызывающих
гибель 50% (ЛK50) особей и определение диапазона разведений для
хронического опыта.
В хроническом опыте учитываются следующие
показатели:
выживаемость оценивают по
количеству живых особей в течение опыта, размножение
- по динамике появления кладок, потенциальную и реальную плодовитость - по числу яиц в кладках,
полученных от каждого моллюска за период опыта, и количеству молоди, вышедшей
из кладок, в абсолютных величинах и процентах к исходному числу яиц в кладках;
суточный рацион находят по
разности между начальным количеством сырого корма и его остатком. Задаваемую
порцию корма взвешивают, остаток изымают, обсушивают и вновь взвешивают. Для
каждой размерной группы особей вычисляют кормовой коэффициент (КК) по формуле
КК=Р/ΔР,
где Р -
масса съеденного за сутки корма (г),
ΔР - средний
суточный прирост массы моллюска (г).
Этот показатель характеризует интенсивность
потребления корма подопытными моллюсками по сравнению с контролем;
водно-солевой обмен оценивают по
массе тела и раковины, количеству полостной жидкости, а также воды и зольных
элементов в мягких тканях. Данные параметры определяют при закладке опыта и по
его окончании;
высоту и ширину раковин измеряют
штангенциркулем. За высоту принимают расстояние от вершины раковины до наиболее
выступающего края устья, а за ширину - диаметр раковины в наиболее широкой ее
части;
для определения общей
массы моллюска его обсушивают фильтровальной бумагой, не надавливая
на ногу, и взвешивают. При определении массы
тела и раковины ножницами разрезают раковину по швам витков,
освобождают тело, обсушивают фильтровальной бумагой и взвешивают на
аналитических или торзионных весах (с точностью до 0,001 г). Тела моллюсков
каждой размерной группы фиксируют 96% этиловым спиртом в предварительно
откалиброванных бюксах. Осколки раковин также взвешивают. Путем расчета (общая
масса моллюска минус масса тела и раковин) определяют количество полостной
жидкости (на 1 г сырой массы тела);
для определения сухого
остатка тела массу зафиксированных животных (в бюксах) доводят до
постоянной величины в термостате при температуре 103-105°С. Количество сухого
остатка рассчитывают на единицу сырой массы;
по разнице сырой и сухой массы определяют количество
воды в теле моллюска и судят о степени обводненности или обезвоживании тела под
воздействием токсиканта;
сухой остаток тела сжигают в
откалиброванных тиглях при температуре 450ºС в муфельной печи.
Рассчитывают количество золы на единицу массы сухого остатка тела. По
количеству золы судят об изменении минерального обмена. Количество
органического вещества рассчитывают по разности массы сухого остатка и золы;
интенсивность дыхания оценивают по
количеству потребленного кислорода на 1 г живой массы прудовика за 1 ч. и
выражают в мг O2/г/час. Для этого в респирометры заливают воду из
аквариумов с соответствующей концентрацией вещества в фунте. Для каждого
разбавления используют 2 респирометра. В один из них помещают животных, у
которых предварительно определены масса и объем тела, другой оставляют без
моллюсков. Респирометры герметически закрывают, чтобы не осталось воздушных
пузырьков, отмечают время начала опыта и помещают в термостат на 2 ч.
(20-22°С), после чего из них отбирают пробы воды в калиброванные пикнометры, в
которых измеряют остаточное количество кислорода.
Количество потребляемого кислорода (М) определяют по
формуле
М = (m0-m)·(V1-V2)/P·t,
где m0 - содержание
кислорода, растворенного в воде респирометра без моллюсков, мг О2/г/час,
m - содержание кислорода в
воде респирометра с моллюсками, мг/л,
V1 - объем сосуда
с моллюсками в мл,
V2 - общий объем
тел моллюсков в мл,
Р - общая масса тел моллюсков
в граммах,
t - продолжительность
экспозиции в часах.
Для получения показателей, характеризующих размножение и плодовитость моллюсков,
отложенные кладки изымают из аквариумов, просчитывают число яиц в кладках и
помещают в химические стаканы на 200 см3 с соответствующей
концентрацией вещества в ДО для дальнейшего развития, на грунте. В стакан
вставляют каркас из проволоки, обтянутый газ-ситом на урезе воды, для
предотвращения потери молоди при их избегании. По мере испарения воду постоянно
добавляют до сетки.
Учитывают число вышедшей из кладок молоди. О
выживаемости эмбрионов судят по количеству появившейся молоди в процентах от
общего числа отложенных яиц.
Критерием хронического действия токсиканта на
моллюсков являются:
а) достоверное отклонение выживаемости моллюсков в
опыте от выживаемости их в контроле в срок до 60 сут;
б) угнетение интенсивности потребления кислорода на
25%;
в) угнетение водно-солевого обмена на 25%.
Для обработки результатов
хронических опытов пользуются общепринятыми методами математической статистики
(раздел
4).
В процессе анализа материала определяют: летальные
концентрации - ЛK25, ЛК50, ЛК100, а также
пороговый (минимально действующий) и максимально допустимый уровень (МДУ).
3.13 Установление максимально допустимого уровня вещества в донных
отложениях по показателям жизнедеятельности хирономид (Chironomus dorsalis
Meigen, Ch. thummi Kieffer, Ch. plumosus Iinne)
3.13.1 Принцип метода
Метод основан на установлении различий выживаемости,
прохождения стадий развития (метаморфоз), сроков вылета комаров и других
показателей в присутствии нормируемого вещества в ДО (опыт) и в контроле.
Критерием токсичности является статистически
достоверное снижение выживаемости и показателей жизнедеятельности хирономид в
опыте по сравнению с контролем в острых (10-сут.) и хронических (30-сут.)
опытах.
3.13.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- бинокуляр (МБС-10), увеличение 3.5-88х;
- весы лабораторные общего назначения, ГОСТ
24104-88;
- вода питьевая, СанПиН
2.1.4.559-96;
- дрожжи хлебопекарные, ГОСТ 171-81;
- калий двухромовокислый, ГОСТ 4220-75;
- кристаллизаторы объемом до 500 см3,
кюветы фотографические 13×16 см, высотой 2,5-3 см, или пластмассовые
емкости разной формы для пищевых целей;
- палочки стеклянные, ГОСТ
29227-91, ГОСТ
25336-82;
- термометр, ГОСТ
112-78;
- трубки, пипетки стеклянные, 2 кл. точности, ГОСТ
29227-91;
- шкаф сушильный, t° до 150°С с точностью до ±1°С;
- чашки Петри и Коха, ГОСТ
25336-82.
3.13.3 Условия выполнения исследований
Опыты проводят в помещении без вредных испарений и
газов при температуре 18-20°С. Грунт и воду доставляют из незагрязненного
водоема или водотока или используют питьевую дехлорированную воду, которую
отстаивают 7-14 сут. и аэрируют. Вода должна соответствовать СанПиН
2.1.4.559-96. Подготовка грунта осуществляется, как указано в 3.1.
3.13.4 Характеристика тест-объекта
В опытах используется культивируемая в лаборатории
культура Chironomus dorsalis [3]
или личинки хирономид, отобранные в чистом водоеме (Ch. dorsalis, Ch. thummi,
Ch. plumosus).
Chironomus dorsalis - представитель бентосных
организмов инфауны. Он относится к широко распространенному семейству
хирономид, личинки которых обитают в илистых грунтах, строя трубчатые домики.
Окукливание в оптимальных условиях наступает на 36-38 сут. Стадия куколки
длится 2-3 суток. В конце этой стадии куколки всплывают на поверхность воды,
где происходит вылет имаго. Общая продолжительность жизни комаров 3-5 сут. В
период размножения комары не питаются. Кладки яиц откладываются на водную
растительность. После выклева личинки несколько дней плавают в толще воды, а
затем оседают на дно. Их рост и развитие определяются условиями питания,
дыхания, качеством грунта, температурным режимом, плотностью популяции и др.
Особенности развития комаров следует учитывать при содержании культуры и
выполнении экспериментов.
3.13.5 Острые опыты
Опыты проводят с 4-6 концентрациями в двух
повторностях. В опытные и контрольные емкости помещают по 10 особей.
Длительность острого опыта 96-120 часов. Смена грунта и воды не производится.
До стадии куколки личинок кормят пекарскими дрожжами из расчета 30-40 г/м2.
Учитывают: выживаемость, активность, окраску.
3.13.6 Хронические опыты
Для хронического опыта составляют ряд концентраций
согласно результатам острых опытов. Опыты проводят в 3 повторностях. Экспозиция
опыта - 30 сут. В каждую опытную емкость и контроль помещают по 10 личинок
хирономид. Кормят дрожжами. Смену ДО производят, исходя из стабильности
исследуемого вещества, смену воды - по мере накопления метаболитов и появления
бактериальной пленки на поверхности воды.
3.13.7 Учет и оценка результатов
Данные подвергаются статистической обработке (раздел
4).
Результатом острого эксперимента является
установление концентраций исследуемого вещества в донных отложениях, вызывающие
гибель 50% (ЛК50) особей и определение диапазона разведений для
хронического опыта.
В хроническом эксперименте учитывают: выживаемость,
активность, окраску, процент и сроки вылета комаров, процент особей с
деформациями у куколок и имаго.
С помощью пробит-анализа (графически) определяют ЛК0,
ЛК25, ЛК50, ЛК100, а также ЭК0; ЭК25.
3.14
Установление максимально допустимого уровня вещества в донных отложениях по
показателям жизнедеятельности олигохет (Limnodrilus hoffmeisteri Claparede, L.
udekemianus Сlaparede)
3.14.1 Принципы метода
Метод основан на установлении различий выживаемости,
размножения, поведенческих реакций, регенерационной способности олигохет, в
присутствии нормируемого вещества в ДО (опыт), и в контроле.
Критерием токсичности является снижение
жизнеспособности и эффективности регенерации олигохет в опыте по сравнению с
контролем в острых (10-суточных) и хронических (60-суточных) опытах при
доверительной вероятности Р≤0,05. В качестве четко выраженной тенденции
изменения принимается отклонение от контроля на 25% [12].
Отклонение от контроля по поведенческим реакциям
устанавливается визуально. К таким реакциям могут быть отнесены: сбор в
«клубки», передвижение по поверхности грунта, реакция на прикосновение,
«строительство домиков» и т.д.
3.14.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- бинокуляр (МБС-10), увеличение 3.5-88х;
- весы лабораторные общего назначения, ГОСТ
24104-88;
- кристаллизаторы диаметром 200 см3;
- лезвие с заостренным концом;
- микропипетки 0,1 см3, 0,2 см3,
ГОСТ
29227-91;
- окуляр-микрометр, ГОСТ
8.211-84;
- препаровальные иглы;
- термометр лабораторный, цена деления шкалы °С -
0,1, ГОСТ
112-78;
- чашки Петри (диаметр 60 и 100 мм), ГОСТ
25336-82;
3.14.3 Условия выполнения исследований
Опыты проводят в помещении без вредных испарений и
газов при температуре 18±2°С.
Проба для определения токсичности представляет собой
слой грунта толщиной 1см (10 г) и 50 см3 воды (1 см над грунтом) -
на чашку Петри (Коха, кювету). ДО для опытов (ил - песок - 1:1) подготавливается
для опытов как указано в подразделе 3.1.
Для экспериментов используется пресная природная
вода из незагрязненного водоема, либо отстоянная в течение 10 сут. дехлорированная,
аэрированная питьевая вода.
Для опытов можно
использовать олигохет из природного источника, предварительно выдержав их в
течение 2 недель в лабораторных условиях при температуре 18-20ºС. Для
каждого опыта отбирают крупных неполовозрелых неповрежденных червей
3.14.4 Характеристика тест-объектов
Для каждого опыта отбирают крупных неполовозрелых
неповрежденных червей.
В качестве тест-объекта используют пресноводный
бентосный организм инфауны - Limnodrilus hoffmeisteri или L. udekemianus. Это
типичные представители низших кольчатых червей семейства Tubificidae, обитающих
в илистом субстрате. Обладают высокой регенерационной способностью, не
требовательны к кислороду. Специальных органов дыхания не имеют, дыхание кожное
и обеспечивается ритмическими колебаниями хвостовой части тела. Питаются
детритом, захватывая его вместе с грунтом. Размножение происходит на протяжении
почти всего года. Черви - гермафродиты, но обычно происходит спаривание. Один
червь способен за месяц отложить 4-5 коконов на поверхность грунта. В коконе
находится от 1 до 20 яиц. Изменение функциональных показателей используется в
качестве критериев токсичности химических веществ на олигохет.
3.14.5 Острые опыты
Для острого опыта готовят 4-5 разведений ДО в 3
повторностях, различающихся по содержанию тестируемого вещества в 10 раз.
Приготовленные образцы донных отложений помещают в чашки Петри 10 г ДО на 50 см3
воды. Контролем служит тот же грунт без исследуемого вещества и вода. Через
сутки в чашки помещают олигохет.
В опытные и контрольные емкости помещают по 10
особей. Длительность острого опыта 7-10 сут. Червей не подкармливают. Смену ДО
и воды не производят.
На 7-10 сут. червей
рассекают острой бритвой на уровне 12-15 сегмента (передний фрагмент).
Фрагменты помещают в микроаквариумы (чашки Петри диаметром 60 мм) с чистой
водой. Смена воды производится каждый день. Специальная подкормка не вносится.
Результаты регенерации регистрируют на 14 сут. Длину и ширину регенератов
измеряют при помощи окулярмикрометра и выражают в мкм или переводят в мм.
3.14.6 Хронические опыты
Для хронических опытов составляется ряд концентрации
исходя из данных острого опыта (с концентрации, в которой отмечалось
статистически достоверное отличие от контроля по выживаемости). Эксперименты
проводят в 3-х повторностях по 20 экз. неполовозрелых крупных червей в каждой
чашке. Экспозиция опыта - 60 сут. В качестве подкормки может быть использован
сапропель или дрожжи. Менять воду достаточно 1 раз в неделю, грунт - в
зависимости от стабильности регламентируемого вещества. Указанием на
необходимость смены воды может служить образование на поверхности бактериальной
пленки. Содержание вещества определяют в начале опыта, при смене ДО и в конце
эксперимента.
3.14.7 Учет и оценка результатов
Данные подвергаются статистической обработке (раздел
4).
Результатом острого эксперимента является установление
концентрации вещества в донных отложениях, вызывающей гибель 50% особей (ЛК50)
за 10 сут. и определение диапазона разведений для хронического опыта.
Эффективность регенерации (Е) находится по формуле
E = l/n,
где l - длина регенератов в мкм,
n - число метамеров регенеранта.
Объем (V)
вычисляют по формуле:
![]()
где π = 3,14,
d - ширина регенерата в мкм,
l - длина регенерата в мкм.
Данные заносятся в таблицу
3.13.
Таблица 3.13
Результаты острых опытов
|
Вариант опыта, сут. опыта |
Выживаемость червей,
% |
Выживаемость фрагментов,
% |
Показатели регенерации |
|||
|
длина, мкм |
ширина, мкм |
Объем V, мм3 |
эффект, реген. Е, мм |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Критерием хронического действия токсиканта на
олигохет являются:
достоверное отклонение выживаемости подопытных олигохет от
контрольных в течение 60 сут;
замедление срока наступления
половозрелости (наблюдения ведутся каждые 5 сут. - крупные ооциты хорошо
просвечивают через прозрачную стенку тела);
плодовитость (по появлению
«пояска», смещение его к головному концу, отложение на грунт беловатых
коконов);
качество потомства (по
выживаемости и реакции на раздражение, а так же по регенерационной способности
молоди).
Форма записи результатов хронического эксперимента представлена в таблице 3.14
Результаты заносят в таблицу 3.14
Таблица
3.14
Результаты
хронического эксперимента с олигохетамн (% к К)
|
Время экспозиц., сут. |
Вариант |
Выживаемость, % |
Наступление половозрелости, сут. |
Кол-во коконов, шт. |
Кол-во вылупив. молоди, шт. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МДУ
вещества в ДО для олигохет считается такой, при котором не обнаружено статистически
достоверных отличий от контроля ни по одному из наблюдаемых показателей.
Концентрации (ЛК100; ЛК50; ЛК25; ЛК0 и ЭК100; ЭК50; ЭК25; ЭК0) определяются на основании экспериментальных данных с помощью одного из приведенных в гл. 4 статистических или графических методов.
3.15
Установление максимально допустимого уровня вещества в донных отложениях по
показателям жизнедеятельности рыб
3.15.1 Принцип метода
Метод основан на установлении различий показателей
жизнедеятельности бентосоядных рыб на разных стадиях онтогенеза (эмбрионы, личинки,
сеголетки, взрослые) в опыте (ДО - вещество - вода) с таковыми в контроле (ДО -
вода).
Критерием острой токсичности является гибель 50% и
более эмбрионов, личинок и сеголеток рыб за 96 ч. в тестируемых ДО по сравнению
с контролем.
Критерием хронической токсичности является
статистически достоверные отличия по выживаемости эмбрионов, личинок осетровых,
сиговых, сеголеток карповых и взрослых аквариумных рыб в течение 10-60 сут, а
также активность спермиев, процент оплодотворения, синхронность развития
эмбрионов, характер вылупления предличинок, частота сердечных сокращений
эмбрионов и предличинок, поведенческие реакции предличинок, рост, частота и
характер аномалий развития эмбрионов и личинок; морфо-физиологические
показатели сеголеток и взрослых рыб в опыте по сравнению с контролем.
3.15.2 Средства измерений, вспомогательные устройства, материалы и
реактивы
Используются:
- аквариумы от 10 до 200 дм3;
- аквариумные водонагреватели с датчиком;
- аппараты Вейса по числу вариантов опыта;
- бинокуляр МБС - 10, увеличение 3.5-88х;
- бихромат калия, ГОСТ 4220-75;
- бумага масштабно-координатная, ГОСТ 334-73;
- ведра, тазы и кюветы разных размеров;
- весы аналитические с разновесами, весы
равноплечные на 100 г, ГОСТ 24104-88; ГОСТ
24104-88;
- весы торзионные, ВТ-500, с ценой деления 1 мг,
градуирован при t° равной 20°С;
- вода дистиллированная, ГОСТ 6709-72;
- вода питьевая дехлорированная, СанПиН
2.1.4.559-96;
- карандаши по стеклу, лейкопластырь, фиксирующие и
дезинфицирующие жидкости;
- марля, ГОСТ 9412-93;
- мерные пипетки, бюретки, стеклянные трубки и
палочки, колбы 0,1-1,0дм3, ГОСТ
29227-91, ГОСТ
25336-82;
- металлические зажимы Мора;
- микроскоп МБИ, увеличение в проходящем свете 17.5-2250х;
в отраженном свете - 45-2375х;
- микрокомпрессоры аквариумные, объем аэрации 7,2
л/мин.;
- микротом и необходимые принадлежности для
гистологических исследований;
- набор инструментов и реактивов для исследования
крови;
- ножницы;
- пинцеты, ГОСТ
21241-89;
- покрытия из мелкоячейной сети или дели для
емкостей с рыбой;
- полиэтиленовые кюветы на 0,5 см3 (для
пищевых целей);
- полиэтиленовая пленка, ГОСТ 10354-82,
- реактивы для гистохимии;
- резиновые трубки разного диаметра;
- сачки диаметром 0,5-1 см, ГОСТ
4403-91;
- секундомер, линейки, ГОСТ 427-75;
- скальпели, ГОСТ
21240-89,
- спирт этиловый, ГОСТ
18300-87;
- термооксиметр, 0-9,9 мг/дм3 с
погрешностью до ± 5,0%;
- фенол, ГОСТ 23519-93;
- химические стаканы - 0,2-2,0 см3, ГОСТ
25336-82;
- холодильник для хранения корма и реактивов, ГОСТ
26678-85;
- чашки Петри, ГОСТ
25336-82.
3.15.3 Характеристика тест-объектов
В качестве тест-объектов используют: рыб семейства
осетровых (икра, личинки), сиговых (личинки), карповых (икра, личинки,
сеголетки, годовики), а также аквариумных рыб - да-нио (икра, личинки,
взрослые), гуппи (мальки, взрослые).
Стерлядь -
Acipenser ruthrenus marsilii Brandt.
Пресноводная рыба, постоянно живет в руслах рек.
Нерест происходит на галечном грунте. Эмбриональный период около 4-5 дней.
Бентофаг. Пищу составляют водные личинки насекомых [14].
В качестве тест-объекта используется на ранних (эмбрион, личинка) наиболее
чувствительных стадиях онтогенеза [15].
Осетр сибирский - Acipenser
baerii Brandt обитает в реках Сибири, полупроходная рыба. Икру откладывает на
песчано-галечные грунты. Длительность эмбрионального развития 5-7 сут. Осетр -
бентофаг. Главную пищу составляют гаммариды и личинки хирономид, веснянок,
поденок и т.д. В опытах можно использовать представителей любых видов семейства
осетровых.
Пелядь - Coregonus
peled Gmelin эндемичный для водоемов России вид, населяет озера и реки от
бассейна р. Мезени на западе до Колымы на востоке. Размножение пеляди и
развитие икры характеризуются поздним осенним нерестом при температуре
1,5-3,0°С. Пелядь - преимущественно планктофаг, но не исключено питание
бентосными организмами. В опытах используют личинок как высокочувствительный
тест-объект.
Карп - Cyprinus carpio Linne.
Расселен по всему земному шару в виде одомашненных и
диких форм. Живет в медленно текущих равнинных реках и озерах. Всеяден. Хорошо
культивируются в лабораторных условиях при небольшой плотности посадки и
хорошей аэрации воды. Является устойчивым тест-объектом к действию токсикантов
по показателю выживаемости, но чувствительным по физиолого-морфологическим
показателям. В качестве тест-реакций используют физиолого-биохимические,
патоморфологические показатели [16],
а также характер накопления токсикантов, в том числе и по пищевой цепи.
Данио - Brachydanio
rerio (Hamilton-Buchanan) - икромечущая аквариумная рыба.
Данио содержат круглогодично в аквариумах разной
емкости (1 г ихтиомассы на 1 л воды) при температуре 22+2° С. Кормят сухим
кормом, с добавлением живого (дафнии, циклопы, олигохеты, хирономиды). В
аквариумных условиях хорошо размножается, поэтому можно использовать в качестве
тест-объекта круглый год.
Гуппи - Lebistes
reticulatus (и другие виды) - широко распространенная аквариумная живородящая
рыбка с ярко выраженным половым диморфизмом. Кормят рыб сухим и живым кормами,
в том числе и мелкими червями и личинками хирономид. Можно использовать для
оценки передачи химического вещества по трофической цепи и последствий его
накопления.
3.15.4 Подготовка к выполнению исследований с икрой и личинками рыб
Перед началом опытов готовят ДО (песок), вносят
исследуемое вещество, определяют его содержание в исходных ДО и смешивают с
крупным чистым прокаленным песком, приготавливая 5-6 разбавлений (см. подраздел
3.1). Соотношение грунта и воды 1:9. В контрольный вариант вещество не
вносят. ДО раскладывают в плоские кюветы (высотой 5-6 см) слоем 1 см и помещают
в установи [17].
Установка с проточностью, состоит из аппарата Вейса, конструкции («этажерки»),
к которой друг над другом крепятся полиэтиленовые кюветы с отверстиями по
периметру на уровне поверхности воды. Проточность регулируется таким образом,
чтобы вода из аппарата Вейса протекала через установку в течение суток. Периодически
верхнюю и нижнюю кюветы меняют местами. Проточность обеспечивает колебательное
движение икринок, улучшение газового режима, а также в значительной степени
снижает опасность сапролегниоза.
Опыты с икрой и личинками
осетровых и личинками сиговых рыб проводят в инкубационном цехе при
температуре, соответствующей оптимальному развитию рыб на ранних стадиях
онтогенеза, с использованием воды, поступающей в инкубационные аппараты.
Опыты с сиговыми можно проводить в лаборатории при
поддержании оптимальных условий: температура 2-5°С, содержание кислорода 8-10
мг/дм3. В этом случае личинки тотчас после выклева доставляются в
лабораторию в полиэтиленовых мешках с водой, насыщенной воздухом (кислородом).
В лаборатории личинки вместе с водой осторожно переливаются в аквариум, который
помещается в промышленный холодильник с прозрачной дверцей, с постоянной
температурой (3±1ºС) и аэрацией. Для опытов используются полиэтиленовые
пищевые кюветы, на дно которых раскладывается чистый грунт (К) и грунт, с
внесенным в него исследуемым веществом (О). Подготовленные кюветы помещают в
холодильник для выравнивания температуры. После чего в них помещают по 10
личинок. Опыты также проводятся в холодильной камере.
Опыты с икрой и личинками данио проводят в
лабораторных условиях при температуре 22-26°С. Для получения икры самок и
самцов рассаживают в разные аквариумы и кормят живым кормом. К концу 2 недели,
когда брюшко самок увеличивается в размере, рыб помещают в нерестовый аквариум
со свежей водой жесткостью не более 4,0 мг-экв/дм3, температурой
около 27°С и рН 6,8-6,9. В нерестовый аквариум вставляется сетчатый садок с
ячеей 3 мм до середины аквариума. В него утром помещают самок и кормят сухим
кормом, а вечером 2-3 самцов на каждую самку. Еще раз кормят всех рыб и гасят
свет. Стимулом к нересту служит утреннее включение света. Отложенная и
оплодотворенная икра, проходя через сетку, опускается на дно. Через 48 ч. после
нереста завершается выклев предличинок, а еще через 48 ч. предличинки переходят
на активное питание. Сетка предохраняет икру и личинок от поедания их
производителями.
3.15.5 Проведение исследований с икрой и личинками рыб
Опыты с икрой осетровых можно проводить в 2
вариантах:
а) не обесклеенная икра быстро раскладывается на
песок, равномерно распределяясь по дну кюветы. Икру оплодотворяют спермой,
активированной раствором исследуемого вещества в концентрации, соответствующей
таковой над опытными ДО (определяется в предварительных опытах). Через 3 мин.,
когда икринки приклеятся к песку, жидкость осторожно отбирают пипеткой и
заливают чистой водой, сменяя ее дважды. После чего чашки с оплодотворенной
икрой ставят в установку;
б) икру оплодотворяют, обесклеивают и помещают в
опытные емкости с регламентируемым веществом (опыт) и чистыми (контроль) ДО с
водой.
На протяжении всего инкубационного периода
определяют выживаемость эмбрионов и морфофизиологические показатели.
Опыты с личинками проводятся также в двух вариантах:
а) вылупившихся из икры личинок оставляют в тех же
вариантах опыта и наблюдают за выживаемостью, сердцебиением, возникновением
аномалий до перехода на активное питание;
б) интактных личинок тотчас после вылупления в
инкубационном цехе помещают в подготовленные кюветы (ДО + вода - К, ДО + вода +
вещество - О), по 10 шт. в 3 повторности в каждом варианте. Опыты можно
проводить с проточностью (установка) и без проточности.
Перед постановкой опыта 20-30 личинок измеряют и
взвешивают на торзионных весах, определяют сердцебиение и интенсивность дыхания
(исходные величины).
Опыты с личинками сиговых и аквариумных рыб выполняют
по той же схеме.
Для опытов с икрой и личинками данио используют
чашки Петри или чашки Коха. Опыты проводятся без проточности в лабораторных
условиях при температуре 25-27°С. Чашки расставляются на стеллажах, закрытых со
всех сторон полиэтиленовой пленкой. Свет - рассеянный. Длительность опытов
определяется периодом эмбрионального развития и перехода предличинок на
активнее питание. Опыты с личинками можно продлить до 20-30 сут. В этом случае
их нужно кормить науплиусами артемии, коловратками, молодью дафний и др.
3.15.6 Учет и оценка результатов в опытах с икрой и личинками
Основными показателями токсичности вещества в ДО
являются выживаемость эмбрионов и личинок, морфологические и физиологические
показатели.
В опытах с осетровыми контролируют выживаемость
ранних зародышей, характеризующую результативность осеменения яиц в токсичной
среде на стадии большой желточной пробки, когда четко обнаруживаются как
дегенерирующие активированные, так и не активированные (партеногенетические,
полиспермные) яйца как в контроле, так и в опыте. Кроме того, определяют
синхронность развития и выживаемость эмбрионов и предличинок на 3, 16, 22, 29,
32, 34, 35, 41, 43 стадиях развития [18],
характер вылупления предличинок, частоту сердечных сокращений эмбрионов и
предличинок, переход на активное питание, рост (длина и масса) предличинок и
личинок, количество и характер аномалий развития (по отклонениям от типичного
развития), интенсивность дыхания. Определяется также активность спермиев.
Продолжительность периода поступательного движения
спермиев определяют пятикратно в каждом эокуляте 5 самцов. Для чего на
предметное стекло помещают каплю чистой (контроль) или каплю воды с исследуемым
веществом из придонного слоя опытных систем (ДО - вещество - вода). В каплю
вносят спермин на конце препаровальной иглы и помещают в поле зрения
микроскопа. Как только движения спермиев из колебательных переходят к поступательным,
включают секундомер. Определяют длительность периода поступательного движения.
В опытах с личинками определяют рост (прирост длины
и массы тела), характер поведения (положение в пространстве, скорость
перемещения, реакция на прикосновение), возникновения аномалий развития,
отставание в развитии, ритм сердечных сокращений, интенсивность дыхания,
морфометрические признаки: длина, высота тела, желточного мешка, масса (у
погибших в течение опыта) и после окончания опыта.
В опытах с данио учитывают гибель эмбрионов,
длительность эмбрионального периода, время вылупления, состояние предличинок,
наличие аномалий, сердцебиение эмбрионов и предличинок. Личинок оставляют в тех
же чашках и определяют выживаемость, время перехода на активное питание.
В опытах с интактными личинками определяют те же
показатели, что и у осетровых и сиговых рыб (см. выше).
3.15.7 Подготовка к выполнению исследований с сеголетками и взрослыми
рыбами
Сеголеток или годовиков карпа доставляют из
благополучных в эпизоотическом отношении рыбоводных хозяйств в молочных флягах
или рыбоводных мешках и осторожно вместе с водой переливают в аквариумы
(100-200 дм3). Постепенно добавляют отстоянную, аэрированную
питьевую воду. К концу периода акклимации (14 дней) рыбы оказываются в дехлорированной
питьевой воде. Плотность посадки 3 г ихтиомассы на дм3 воды.
Содержание кислорода 6-8 мг/дм3. При необходимости - аэрация.
Температура плюс 24±2°С. Кормят рыб живым кормом (хирономиды, олигохеты) и
искусственными кормами высокого качества. Аквариумы ежедневно очищают от
остатков корма и фекалий и контролируют температурный и газовый режим с помощью
термооксиметра или методом Винклера. Гуппи содержат в аквариумах, с плотностью
посадки 1 г ихтиомассы на 1 л воды. К условиям содержания рыбы неприхотливы:
жесткость воды от 2 до 3,5 мг-экв/дм3, реакция рН 6,8-7,0,
температура 24 - 27°С. Воду аэрируют с помощью микрокомпрессоров. Фекалии со
дна аквариума осторожно убирают при помощи сифона. Кормят гуппи 1-2 раза в
сутки сухим (дафнии, гаммарусы) или живым (хирономиды, олигохеты дафнии)
кормами. Для получения молоди отбирают половозрелых рыб в возрасте 1-2 лет
(продолжительность жизни гуппи в аквариумных условиях 3-3,5 года). Самку,
готовят к вымету, помещая в отдельную нерестовую емкость объемом не менее 4 л,
с температурой воды 25 ± 1°С и большим количеством мелколистных растений.
Готовность самки к вымету мальков определяют по наличию хорошо заметного
темного пятна перед анальным плавником. При этом форма брюшка приближается к
прямоугольной, и оно становится намного шире спины. После окончания вымета,
самок изолируют, так как они поедают потомство. Мальки рождаются
сформированными. Лучшим кормом для них является «пыль», состоящая из инфузорий,
коловраток, молоди ветвистоусых рачков и науплиусов рачка артемия. Мальков
также можно кормить измельченным сухим кормом для рыб.
3.15.8 Проведение исследований с сеголетками и взрослыми рыбами
Опыты с сеголетками карпа проводят в аквариумах
40-60 дм3, куда помещают заиленный песок чистый (К) и песок с
тестируемым веществом (О) - 5-6 разведений ДО, в 3-х повторностях по 5-10
особей. При необходимости используют аэрацию. Предварительно в ДО помещают
олигохет в качестве корма для рыб и для рыхления ДО. Одновременно в плоские
кюветы с ДО, с аналогичной концентрацией вещества, что и в опытах с рыбой,
помещают олигохет (резерв), постоянно подсаживая новых по мере скармливания их
рыбами.
Острый опыт проводят в течение 4 сут. Исходя из
результатов острого опыта, определяют диапазон концентрации вещества в ДО для хронических
опытов. Если гибели не отмечается опыты продолжают.
Хронический опыт (30-63 сут.) с сеголетками проводят
по аналогичной схеме. Частичную смену воды производят 1 раз в 10 сут., ДО - в
зависимости от стабильности регламентируемого вещества. В день смены воды и ДО
определяют содержание в них тестируемого вещества.
Опыты со взрослыми данио и гуппи проводят по той же
схеме, что и с сеголетками карпа.
3.15.9 Учет и оценка результатов в опытах с сеголетками и взрослыми
рыбами
В остром опыте регистрируют поведенческие реакции
рыб (характер движения, реакция на прикосновение, пищевой рефлекс) и
выживаемость. Математическим или графическим методом определяют ЛК50
(раздел
4).
В хроническом опыте у
подопытных и контрольных рыб, кроме перечисленных выше показателей, определяют
внешний вид (состояние кожных покровов, плавников, органов зрения), поедаемость
корма, упитанность, рост, дыхание, состояние внутренних органов (состояние
жабр, консистенция мышц, печени, наличие полостной жидкости, гиперемия,
изменение цвета печени, переполнение желчного пузыря), проводят гистологический
анализ печени, почки, селезенки, мозга, определяют морфо-физиологические
индикаторы (относительная масса внутренних органов к массе тела); содержание
эритроцитов и гемоглобина в крови, лейкоцитарную формулу, гематокрит [19];
при возможности, активность ключевых ферментов метаболизма.
Оставшуюся часть органов и тканей замораживают
(отдельно в кюветах) и определяют накопление исследуемого вещества в мышцах,
скелете, жабрах, печени, почке, желчном пузыре, в полостном жире (в зависимости
от тканевой специфичности регламентируемого вещества). Определяют
транслокационный показатель - передачу токсиканта по трофической цепи и
коэффициент кумуляции.
Все полученные результаты заносят в рабочий журнал.
Обработку результатов производят методами вариационной статистики (раздел
4).
По полученным данным строят кривые зависимости
концентрация - эффект по всем определяемым показателям. Методом пробит-анализа
определяют ЛК0; ЛК25; ЛК50; ЛК100;
ЭК0; ЭК25; ЭК50; ЭК100, и
максимальные допустимые уровни (МДУ) по всем показателям. В их ряду минимальный
- это МДУ в ДО исследуемого вещества для рыб.
Максимально допустимые
уровни (МДУ) по каждому показателю заносят в таблицу 3.15.
Таблица
3.15
Сводная таблица допустимых уровней вещества в ДО для рыб
|
Организм (вид, возраст) |
Показатели |
МДУ |
|
Эмбрионы |
Выживаемость |
|
|
|
Возникновение аномалий |
|
|
|
Время вылупления |
|
|
|
Длительность эмбрионального периода |
|
|
|
Переход на активное питание |
|
|
|
Синхронность развития эмбрионов |
|
|
|
Сердцебиение эмбрионов |
|
|
Личинки |
Выживаемость |
|
|
и мальки |
Дифференциация пола (в хронических опытах) |
|
|
|
Поведенческие реакции |
|
|
|
Рост |
|
|
|
Реакции на внешние раздражители |
|
|
Сеголетки |
Выживаемость |
|
|
взрослые |
Внешний вид |
|
|
рыбы |
Гематологические и биохимические показатели |
|
|
|
Накопление веществ в тканях |
|
|
|
Поедание корма |
|
|
|
Патологоанатомическое вскрытие |
|
|
|
Прирост ихтиомассы |
|
|
|
Состояние наружных покровов |
|
|
|
Состояние жаберного аппарата |
|
|
|
Состояние внутренних органов |
|
|
|
Органолептические свойства |
|
|
|
Характер и частота дыхания |
|
|
|
Функциональная и материальная кумуляция |
|
3.16
Определение генотоксичности донных отложений с регламентируемым веществом
3.16.1 Вводные замечания
Генотоксичность вещества в ДО исследуется на генном,
хромосомном или геномном уровне. По этим данным определяются специфические
эффекты и отдаленное действие исследуемого вещества. Наличие эффектов играет
важную роль при определении класса экологической опасности вещества.
Для оценки генотоксичности вещества в ДО
рекомендуется использовать следующие тест-системы:
- хирономиды - Chironomus thummi, Chironomus dorsalis
(дифференциальная активность генов политенных хромосом слюнных желез и
нарушение их структуры);
- укореняющиеся макрофиты - Elodea candensis,
Vallisneria spiralis, Lemna minor (учет хромосомных аберраций в корнях растений
в митозе);
- плодовая мушка - Drosophyla melanogaster (частота
доминантных эмбриональных деталей, частота морфозов, потери и нерасхождение
хромосом - геномные мутации, отдаленные последствия на потомство);
- частота образования микроядер в эритроцитах рыб.
3.16.2 Дифференциальная активность генов хирономид
Метод основан на определении цитогенетических
различий в политенных хромосомах личинок хирономид, содержащихся в чистых ДО
(контроль) и исследуемых ДО с различными концентрациями исследуемого вещества.
Критерием токсичности является достоверно значимое
(Р≤0,05) появление хромосомных перестроек по сравнению с контролем и
нарушение пуффинга в политенных хромосомах из слюнных желез личинок хирономид
во время метаморфоза за 48 ч. на IV стадии развития в 6-9 фазах.
Для выявления хромосомных аберраций готовятся
давленные препараты политенных хромосом из слюнных желез хирономид на стадии
предкуколки. Окрашивание препарата производится ацетоорсеином по методике
приведенной в работе [19].
3.16.2.2 Средства
измерений, вспомогательные устройства, материалы и реактивы
Используются:
- краситель ацетоорсеин (0,5 орсеина и 45% уксусной
кислоты);
- лак для ногтей с кисточкой (для герметизации
препарата);
- ледяная уксусная кислота;
- микроскоп «Биолам»;
- предметные и покровные стекла для
микроскопирования, ГОСТ 9284-75
и ГОСТ 6672-75;
- препаровальные иглы;
- среда для заливки (краситель, разведенный 45%
уксусной кислотой в соотношении 1:3);
- тонкий пинцет;
- фильтровальная бумага, ГОСТ 12026-76.
3.16.2.3 Опыты
проводятся в помещении без вредных испарений и газов при температуре 22±2°С.
Для приготовления стандартного субстрата используют речной ил и песок, взятые
из чистых водоемов и проверенные на отсутствие загрязнения. Обязательным
является цитогенетический анализ политенных хромосом из слюнных желез личинок
хирономид, выдержанных не менее 10 сут. в донных отложениях водного объект,
отобранных для эксперимента.
3.16.2.4 Внесение
вещества в грунт производится по методикам, описанным в разделе 3.1.
В качестве тест-объекта рекомендуется лабораторная культура Chironomus thummi
или Сh. plumosus. Кариотип каждой
культуры представлен 4 политенными хромосомами, в некоторых местах имеющих
гетерогенные участки (неполная конъюгация). Кариотип Ch. Thummi приведен [21].
Для синхронизации развития хирономид отбирают
заранее, когда у личинок потемнеет голова на первой фазе IV возраста, а затем
ждут момента набухания грудных сегментов и укорочения тела, когда в политенных
хромосомах начинают появляться пуфы метаморфоза.
В ходе проведения работы на политенных интерфазных
хромосомах следят за дифференциальной активностью генов во время метаморфоза и
за появлением хромосомных аберраций.
3.16.2.5 Определение
генотоксичности вещества в ДО проводят на предкуколке хирономид в процессе
метаморфоза, когда дифференциальная активность генов наиболее выражена. Личинок
хирономид наблюдают с 36 по 38 день развития, которое проходит при температуре
20-25°С. Стадия предкуколки характеризуется набуханием грудных сегментов,
укорочением и заострением тела и уменьшением ложных ножек. Метаморфоз
происходит на IV стадии развития в фазах с 6 по 9. Изменение цвета тела с
красного на темно-серый указывает на окончание метаморфоза.
Препараты политенных хромосом из слюнных желез
готовят по методике, приведенной в [21].
Для этого предкуколку помещают на фильтровальную бумагу для обсушивания, затем
переносят на предметное стекло и тонко отточенным пинцетом тянут за мандибулы,
отрывая голову. Вместе с головой из тела личинки тянется кишечник, по бокам которого
на слюнных протоках видны слюнные железы. Препаровальной иглой слюнные железы
отделяются от остальных тканей и окрашиваются ацетоорсеином в течение 15 минут.
После окрашивания они помещаются на чистое предметное стекло в каплю среды для
заливки и покрываются покровным стеклом. На покровное стекло помещается кусочек
фильтровальной бумаги и большим пальцем, без сдвигов в сторону, клетки слюнных
желез раздавливаются. Излишняя среда для заливки впитывается в фильтровальную
бумагу. Затем бумагу удаляют, а края стекла заделывают лаком для ногтей, для
предохранения препарата от высыхания.
3.16.2.6
Генотоксичность вещества в ДО оценивают по нарушению структуры политенных
хромосом. При этом возможны разрывы, перетяжки, дезинтеграция концов хромосом,
укорочение хромосом. Появление хромосомных аберраций более 20 % по сравнению с
контролем говорит о генотоксичности препарата. Достоверность результатов
обсчитывается статистически по алгоритмам биометрии; (раздел
4).
Нарушение пуффинга не обсчитывается статистически. О
мутагенной активности тестируемого вещества судят по его влиянию на пуффинг в политенных
хромосомах. Появление новых пуфов или же нарушение пуффинга говорит о возможном
генетическом репрограмировании и нарушении дифференциальной активности генов.
При этом на 4-х хромосомах исследуются только короткоживущие пуфы метаморфоза с
6 по 9 фазы развития хирономид (стадия предкуколки). Предлагается следить за
следующими пуфами метаморфоза [22]:
на первой хромосоме пуф 1G1h-к, увеличивается на 7-8 фазах развития; на второй
хромосоме пуф 2А3b постепенно
сужается, а пуф 2А3е увеличивается на каждой последующей фазе, на этой же
хромосоме на 8 фазе развития появляются пуфы 2D2de и 2J2; на третьей хромосоме
(6 и 7 фазы развития) отмечается пуф 3Dlb, а на 7 фазе появляется пуф 3D1h,
который остается до конца метаморфоза; на 4-й хромосоме хорошо видны тельца
Бальбиани, которые особенно увеличиваются на 8 фазе. На 6 фазе в этих
хромосомах появляется быстро исчезающий пуф 4Dc. Любое нарушение пуффинга
свидетельствует о действии данной концентрации вещества в ДО на
дифференциальную активность генов, а поэтому вещество может рассматриваться как
генетически опасное.
3.16.3 Хромосомные
аберрации в клетках корней макрофитов
3.16.3.1 Метод основан
на определении цитогенетических различий в корнях макрофитов, содержащихся в опытных
(вода - ДО - нормируемое вещество) и контрольных (вода - ДО) средах.
Критерием генотоксичности является нарушение
хромосом в митозе - фрагменты, мосты, отставания, множественные нарушения в
клетках корней высших водных растений.
3.16.3.2 Средства измерений,
материалы, реактивы Используются:
- аквариумы объемом 3-10 дм3;
- ацетоорсеин или ацетокармин;
- вода дистилированная, ГОСТ 6709-72;
- кристализаторы объемом 1 дм3, ГОСТ
25336-82;
- ледяная уксусная кислота, ГОСТ 61-75;
- стаканы, ГОСТ
1770-74;
- термометр, ГОСТ
112-78;
- фильтровальная бумага, ГОСТ 12026-76;
- чашки Петри (Коха), ГОСТ
19908-90;
- этиловый спирт, ГОСТ
18300-87,
3.16.3.3 В хронических
опытах с макрофитами (см. подраздел
3.7) кроме морфометрических показателей определяют гибель клеток в корнях,
содержание хлорофиллов и каротиноидов, а также цитогенетические аномалии
(хромосомные аберрации): мосты, фрагменты, отставание, множественные нарушения
хромосом.
Для анализа используют молодые растущие корни
растений, так как именно в них много делящихся клеток. Препараты готовят
следующим образом. Корешки растений размером 0,5-1 см помещают в фиксатор
Кларка (3 части 96% спирта и 1 часть ледяной уксусной кислоты) на 2-24 часа.
При более длительном выдерживании корней в фиксаторе материал становится
твердым и не пригодным для микроскопирования. После фиксации корешки отмывают в
96% спирте 5 мин., затем в 80-75% спирте 5 мин. и помещают на хранение в 70%
спирт. Материал может хранится в холодильнике в закрытом флаконе с 70% спиртом
в течении 3-5 лет. Для окраски корешков используют 2 % раствор ацетокармина или
ацетоорсеина. Красят корешки в капле красителя в течение 30-40 мин. Для
улучшения проникновения красителя в растительные клетки можно провести подогрев
предметного стекла с каплей красителя и корешками над пламенем спиртовки.
Нагрев стекла не должен быть большим (стекло не должно обжигать при
прикосновении к руке). После окрашивания удаляют остатки красителя, промывают
временные давленные препараты. Микроскопируют при увеличении 8×40.
Расчет частоты нарушений хромосом (хромосомные
аберрации ХА) проводят, находя процент клеток с нарушениями того или иного вида
от общей частоты встречаемости анафаз-телофаз.
Все полученные данные подвергают статистической
обработке (раздел
4).
3.16.4 Определение
генотоксичности и мутагенности веществ по их действию на плодовую муху
Drosophyla melanogaster
3.16.4.1 Методика
основана на определении эмбриотоксичности, тератогенности и мутагенности у
подопытных дрозофил в сравнении с контрольными мухами при действии нормируемого
вещества в ДО.
Критерием токсичности являются достоверные отличия
от контроля по показателям: выживаемость в трех поколениях, потенциальная и
реальная плодовитость, частота доминантных эмбриональных деталей, частота
морфозов, потери или расхождение хромосом (геномные мутации в половых клетках).
3.16.4.2 Средства
измерения, вспомогательные устройства, материалы и реактивы
Используются:
- агар-агар;
- дрожжи, ГОСТ 171-81;
- кисточка;
- культуральные стаканчики на 0,1-0,2 дм3,
ГОСТ
1770-74;
- манная крупа;
- микроскоп МБИ-10;
- пластмассовые крышки для сбора отложенных яиц;
- препаровальные иглы;
-предметные стекла, ГОСТ 9284-75;
- пробирки, ГОСТ
19908-90;
- сахар;
- термостат;
- чашки Петри, ГОСТ
19908-90;
-эфир медицинский.
3.16.4.3 Дрозофила
является удобным экспериментальным объектом для генетических исследований по
следующим причинам: быстрая смена поколений (виды проходят развитие от яйца до
половозрелой особи менее чем за две недели); легкость разведения; дешевизна;
малые размеры мух (разведение не требует больших помещений), многочисленность
потомства, безвредность (не является переносчиками возбудителей каких-либо
известных болезней человека, у взрослых особей нет ротового аппарата колющего
или грызущего типа); соотношение полов (большинство видов дрозофил производят
равное число потомков того и другого пола), легкость коллекционирования. В
кариотипе дрозофилы содержится 4 пары хромосом, что очень удобно для
генетических исследований, у дрозофилы хорошо выражен половой диморфизм. В
кариотипе дрозофилы содержится 4 пары хромосом, что очень удобно для
генетических исследований.
3.16.4.4 Мух содержат в
термостате при температуре плюс 25°С, на питательной среде, содержащей 15 г
агар-агара, 40 г сухих дрожжей, 60 г сахара, 60 г манной крупы.
Исследования проводят на 3-х поколениях дрозофил (F0
- исходное, F1 - первое, F2 - второе, F3 -
третье) в условиях хронического (21 день) действия ДО с внесенным в них
нормируемым веществом. Готовится серия разведений, как указано в 3.1.
Мух F0 содержат на среде с добавлением проб опытных ДО. Мухи F1
развиваются и содержатся на питательной среде с добавлением загрязненных ДО.
ДО с нормируемым веществом добавляют в стандартную
агар - дрожжевую среду для культивирования дрозофил из расчета 50% среды: 50%
ДО. Грунт вносят в горячую готовую среду, тщательно перемешивают и разливают по
культуральным стаканчикам, в контроле в питательную среду (в той же пропорции
1:1) добавляют чистый песок.
Для определения выживаемости помещают в каждый
вариант опыта по 50 самок и 50 самцов каждого поколения. Смену среды производят
каждые седьмые сутки. Подсчет оставшихся в живых мух определяют на 7, 14, и 21
сутки наблюдений.
Потенциальную плодовитость мух оценивают, определяя
количество яиц, отложенных одной самкой. Для этого используют крышечки, залитые
агаровой средой, на которые самки в течении пяти дней откладывают яйца.
Реальную плодовитость
анализируют по количеству потомков на стадии имаго, вылетевших в течение всего
срока лета (10 дней). По полученным данным рассчитывают реальную удельную
плодовитость.
|
Реальная
удельная |
= |
количество
потомков |
|
плодовитость |
количество
самок предыдущего поколения |
Генотоксичностъ загрязненных донных отложений оценивают с помощью метода эмбриональных
деталей (ЭЛ), для чего используют яйца трехдневных мух, предварительно содержащихся
на среде с ДО и нормируемым химическим веществом или развившихся на тестируемой
среде. В каждом из вариантов эксперимента используют по 5 баночек с крышками,
залитыми агаровой средой (на 1 литр питьевой воды берут 10 г агара и 30 г
сахара). В каждую экспериментальную баночку помещают по 40 самок и 45 самцов
(для снижения вероятности откладки самками неоплодотворенных яиц). Самки
откладывают яйца на крышки, которые меняют каждый день в течении пяти суток.
После подсчета отложенных яиц крышки помещают в чашки Петри и в термостат, где
их содержат 48 час. при температуре 25°С. По истечении данного срока проводят
анализ неразвившихся яиц.
При анализе морфозов типа «вырезка на крыле»
используют мух F1 развившихся в среде с ДО и нормируемым веществом. Для
учета используют взрослых половозрелых мух, у которых после наркотизации
просматривают краевую поверхность крыльев. По краю крыла у мух располагаются
мелкие ворсинки, отсутствие которых хорошо видно при увеличении 2×10.
Кроме того, в виде крылового морфоза регистрируют и более серьезные нарушения
поверхности крыла в виде вырезок. Края таких вырезок плавные, четко очерченные.
Появление вырезок связано с гибелью клеток крылового имагинального диска на
стадии личинки в результате неблагоприятного воздействия. Учитывают всю
крыловую поверхность обоих крыльев дрозофилы, просматривая не менее 1000 мух.
Одним из наглядных тестов на мутагенность нормируемых веществ в ДО
является учет геномных мутаций, к числу которых принадлежит тест на потери и нерасхождения половых хромосом.
Для анализа используют мух линии дикого типа (самки) и мух тесторной линии
(самцы). Гибриды первого поколения от скрещивания девственных самок линии
дикого типа с самцами тесторной линии будут двух типов: нормальные и мутантные.
Появление самцов с абрикосовыми бобовидными глазами свидетельствует о
возникновении потерь X-хромосом в гаметах самки, т.е. о возникновении геномных
мутаций. О нерасхождении Х-хромосом судят по появлению самок, имеющих красные
круглые глаза.
3.16.4.6 У мух F0
и F1 в ходе эксперимента учитывают следующие показатели:
выживаемость мух (подсчет
ведут каждые 7 дней, пересаживая дрозофил в чистые стаканчики с культуральной
средой). Учитывают выживаемость не менее 100 особей в каждом варианте опыта и
контроля;
потенциальную и реальную
плодовитость мух. Потенциальную плодовитость - по количеству
отложенных яиц в пересчете на 1 самку. Реальную плодовитость - по количеству
вылетевших потомков по отношению к каждой исходной материнской особи;
частоту доминантных эмбриональных
деталей. Учитывают количество неразвившихся в течение 24 часов яиц. Яйца,
остановившиеся в развитии на ранних этапах эмбриогенеза и оставшиеся белыми по
цвету, регистрируются, как ранние летали. Яйца, начавшие развитие, но
остановившиеся на более поздних стадиях развития темные по цвету, учитывают как
поздние летали. В каждом варианте анализируют не менее 1000 яиц;
частоту морфозов типа вырезка на крыле. Анализ
крыловых морфозов проводят у мух F1 и F2 после развития и
содержания на среде с добавлением тестируемого грунта;
частоту нерасхождений и потерь
Х-хромосом. Анализ проводят у гибридов от скрещивания самок
исследуемой линии с самцами линии-анализатора. Появление исключительных особей
отличающихся по цвету и форме глаз от регулярных потомков служит показателем
возникновения геномных мутаций в половых клетках мух.
3.16.5 Учет частоты
образования микроядер в эритроцитах рыб и покровном эпителии рыб.
3.16.5.1 Метод позволяет
учитывать в цитоплазме эритроцитов рыб частоту образования микроядер, которые
представляют собой фрагменты ядерного материала, элиминирующиеся из ядра клетки
при аберрациях митотических хромосом.
3.16.5.2 Средства
измерения, вспомогательные устройства, оборудование и материалы
Используются:
- микроскоп с фотокамерой;
- мерная посуда для приготовления растворов;
- предметные стекла;
- вегетационные сосуды для рыб;
- краситель Гимза;
- этиловый спирт (96%) для фиксации.
3.16.5.3 Для
приготовления мазков кровь берут из хвостовой вены. Мазки фиксируют в чистом
этаноле, высушивают, окрашивают 10% раствором красителя Гимза и просматривают
под микроскопом
3.16.5.4 Анализируются
мазки, где клетки располагаются равномерно, образуя монослой без наложений и повреждений
цитоплазмы. Учитываются только целые эритроциты.
Для определения частоты клеток с 1 или 2 микроядрами
анализируют 1000 эритроцитов на особь на одно предметное стекло. Перед
подсчетом стекла можно шифровать.
3.16.5.5 Микроядра
определяют в покровном эпителии личинок рыб, выклюнувшихся их икры, которая
инкубировалась на грунтах с дозированным внесением исследуемого вещества и в
контроле.
Для выявления микроядер используют те же методики,
что и для выявления хромосомных аберраций. В препаратах определяют количество
клеток с микроядрами на 1 тыс. клеток и выражают их число в процентах.
4. Рекомендации по статистической обработке результатов испытаний токсичности при определении ПДУ веществ в донных отложениях
4.1
Общие положения
4.1.1
Статистическая обработка данных токсикологических исследований имеет следующие
цели:
- определение достоверных усредненных данных,
характеризующих биологическую эффективность отдельных концентраций исследуемого
вещества в целом;
- оценка достоверности различия средних количественных
значений тест-реакций в разных вариантах испытаний, в частности, в опыте и в
контроле.
4.1.2 Составление
выборок
Выборкой из генеральной совокупности называют «n» элементов, объединенных по одному признаку.
При составлении выборки необходимо выяснить:
- какие элементы генеральной совокупности должны
быть включены в выборку;
- каким должен быть объем выборки.
Включение элементов в выборку производится по схеме
случайного выбора из генеральной совокупности. Чаще всего применяется метод
двухступенчатого выбора. Вначале извлекается случайная выборка в n1 единиц I
порядка. Затем из каждой единицы I порядка отбирается случайная выборка в n2 единиц II
порядка.
Например. Отбор дафний для опыта по изучению токсического
действия вещества. Вначале отлавливают n1 половозрелых дафний (I
порядок), затем рассаживают их по 1 (для уменьшения разброса данных) в емкости.
Из потомства 2 поколения отбирают молодь для опытов (II порядок). Тот же прием
используют в опытах с икрой рыб, с простейшими, моллюсками и т.д.
Для получения достоверных значений с заданной
статистической точностью требуется соответствующее число подопытных организмов
(таблица. 4.1).
4.1.3. Биологическая
эффективность отдельных концентраций выражается либо через количественное
значение тест-реакции объекта в каждой концентрации к концу срока наблюдения
(по отношению к значению в контрольной серии, выраженное в процентах), либо в
виде срока достижения определенной величины тест-реакции объекта при действии
этой концентрации.
Таблица 4.1
Расчетный
объем выборки для получения с заданной точностью соответствующих показателей в
токсикологических экспериментах (цифры округлены до целых величин)
|
Допустимая статистическая ошибка (%) |
Процент прореагировавших особей (сантили) |
||||||||
|
ЭК50 |
ЭК25 ЭК75 |
ЭК16 ЭК84 |
ЭК10 ЭК90 |
ЭК05 ЭК95 |
ЭК01 ЭК99 |
||||
|
±20 |
3-4 |
4-5 |
5-6 |
6-8 |
9-10 |
60-80 |
|||
|
±10 |
10-11 |
12-14 |
15-16 |
20-22 |
28-32 |
200-220 |
|||
|
±5 |
40-43 |
50-54 |
60-64 |
80-86 |
114-124 |
800-860 |
|||
|
±1 |
1000-1070 |
1250-1338 |
1493-1597 |
2000-2140 |
2857-3057 |
20000-140000 |
|||
4.1.4
В тех случаях, когда в контрольной выборке также наблюдаются регистрируемые
изменения (например, гибель), при вычислении отношения опыта к контролю
целесообразно вводить «поправку Аббота», определяемую по формуле
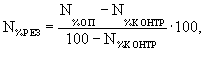
N%РЕЗ - уточненная
величина эффекта вещества,
N%ОП - процент
погибших особей в опыте,
N%КОНТР - процент
погибших особей в контроле.
4.1.5 Если в
качестве регистрируемого используется показатель выживаемости, то, в случае
гибели в контроле более 10 % особей, опыт следует повторить. Исключение
составляют опыты с икрой и личинками рыб, а также с моллюсками из природных
водоемов, где в норме бывает большой отход.
В тех случаях, когда в контроле регистрируемый
показатель отмечается менее, чем у 5% особей, поправку Аббота можно не вводить.
4.1.6.
Дополнительную информацию о возможностях и приемах статистической обработки данных
можно найти в соответствующих руководствах [24-26].
4.2. Первичная обработка данных.
4.2.
Первичная обработка данных
4.2.1 Для всех
повторностей каждой из концентраций на конкретный срок вычисляется среднее
арифметическое значение тест-реакции X по формуле:
![]()
где х - частные значения тест-параметра в каждой из
повторностей (в контрольном варианте или в каждой из концентраций),
n - количество
значений (повторностей) в серии.
4.2.2 В случае
существенных отклонений одной из дат в серии от средней арифметической
целесообразно оценить, не выпадает ли она, в силу каких-либо побочных причин,
из общей закономерности. Для этого проводится вычисление по следующим формулам:
- если сомнительная дата оказалась наименьшей по
значению
![]()
где v - коэффициент оценки принадлежности,
х1 - сомнительная дата (наименьшая),
x2 - дата,
следующая по величине,
xn-1 - дата,
предшествующая наибольшей в серии.
- если сомнительная дата оказалась наибольшей по
значению
![]()
где xn - сомнительная
дата (наибольшая),
xn-1 - дата, предшествующая
по величине,
x2 - дата, следующая за наименьшей в
серии.
Полученный коэффициент v сопоставляется с приведенными в таблице 4.2 величинами для
уровня значимости Р=0,05 и для разного числа повторностей n.
Таблица 4.2
Значение коэффициента v от числа повторностей n
|
n |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
v |
0,96 |
0,81 |
0,69 |
0,61 |
0,55 |
0,51 |
0,48 |
0,45 |
0,43 |
|
|
|||||||||
|
n |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
v |
0,41 |
0,40 |
0,38 |
0,37 |
0,36 |
0,35 |
0,34 |
0,33 |
|
Если вычисленная величина v равна приведенной
в таблице или превышавшее, то оцениваемая дата может быть исключена из выборки
данных. Новое среднее арифметическое значение и все последующие вычисления
производятся без этой даты. Предполагается, что ее появление связано с
проявлением какого-то неучтенного фактора (недостаточно промытая посуда, ошибки
оператора при внесении токсиканта и манипуляциях и др.).
4.2.3
Вычисляется выборочная дисперсия (δ2) и среднее
квадратическое отклонение (δ) значений тест-реакции от среднего (х) для
каждой серии (n):
![]()

4.2.4 Рассчитывается
ошибка среднего арифметического значения (S) тест-реакции по формуле
![]()
4.2.5 Вычисляется
критерий достоверности (td) разности средних значений тест-реакций в
контрольном варианте и в каждой из концентраций (td):
Вычисленные величины критерия td
сопоставляются с табличными значениями (критерий Стьюдента), приведенными в
таблице 4.2 Эти значения (tst) соответствуют
уровню значимости Р=0,05 и числу степеней свободы (k = nоп + nконтр - 2) до 30.
Таблица 4.3
Значения критерия Стьюдента
|
k |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
tst |
12,7 |
4,3 |
3,18 |
2,78 |
2,57 |
2,45 |
2,37 |
2,31 |
2,26 |
2,23 |
|
|
||||||||||
|
k |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
tst |
2,2 |
2,18 |
2,16 |
2,15 |
2,13 |
2,12 |
2,11 |
2,10 |
2,09 |
2,09 |
|
|
||||||||||
|
k |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
tst |
2,08 |
2,07 |
2,07 |
2,06 |
2,06 |
2,06 |
2,05 |
2,05 |
2,05 |
2,04 |
Различие
между средними значениями тест-параметра в опыте и в контроле считается
достоверным, если рассчитанная величина td, при соответствующей
величине k,
равна табличной или превышает ее (td ≥ tst).
4.2.6 Вычисления
достоверности различия по критерию F (Фишера)
Для каждой пары сравниваемых средних величин (опыт и
контроль) вычисляется величина отношения соответствующих дисперсий δ2:
![]()
Всегда берется отношение большей дисперсии к
меньшей, поэтому величина Fэкcп
не может быть меньше 1.
Полученная величина критерия Fэкcп сопоставляется с
табличными значениями (Fст)
для уровня значимости Р = 0,05 при соответствующем числе степеней свободы k1 и k2 (таблице 4.4).
Таблица
4.4
Значения
критерия Фишера
|
k2 |
k1 - число степеней свободы
для большей дисперсии |
|||||||||
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1 |
161 |
200 |
216 |
225 |
230 |
234 |
237 |
239 |
241 |
242 |
|
2 |
18,5 |
19,0 |
19,3 |
19,3 |
19,4 |
19,4 |
19,4 |
19,4 |
19,4 |
19,4 |
|
3 |
10,1 |
9,6 |
9,3 |
9,1 |
9,0 |
8,9 |
8,9 |
8,8 |
8,8 |
8,8 |
|
4 |
7,7 |
6,9 |
6,6 |
6,4 |
6,3 |
6,2 |
6,1 |
6,0 |
6,0 |
6,0 |
|
5 |
6,6 |
5,8 |
5,4 |
5,2 |
5,1 |
5,0 |
4,9 |
4,8 |
4,8 |
4,7 |
|
6 |
6,0 |
5,1 |
4,8 |
4,5 |
4,4 |
4,3 |
4,2 |
4,2 |
4,1 |
4,1 |
|
7 |
5,6 |
4,7 |
4,4 |
4,1 |
4,0 |
3,9 |
3,8 |
3,7 |
3,7 |
3,6 |
|
8 |
5,3 |
4,5 |
4,1 |
3,8 |
3,7 |
3,6 |
3,5 |
3,4 |
3,4 |
3,3 |
|
9 |
5,1 |
4,3 |
3,9 |
3,6 |
3,5 |
3,4 |
3,3 |
3,2 |
3,2 |
3,1 |
|
10 |
5,0 |
4,1 |
3,7 |
3,5 |
3,3 |
3,2 |
3,1 |
3,1 |
3,0 |
3,0 |
Если
Fэксп больше Fст при соответствующем
значении степеней свободы, то различие между сравниваемыми вариантами (между
опытом и контролем) достоверны.
4.2.7 Для
определения достоверности различий в опыте и контроле по показателю
выживаемости можно воспользоваться следующим способом расчета:
а) величину процента Р данного события к определенному сроку рассчитывают по
формуле:
![]()
где n - частота
события,
N - общее число событий;
б) ошибку величины Р (S) находят по формуле
![]()
в) достоверность отличий оценивают по t критерию
Стюдента:
![]()
где Р1
- частота данного события в контроле, в процентах,
Р2 - частота данного
события в опыте, в процентах,
S1 - ошибка процента в
контроле,
S2 - ошибка процента в опыте.
4.2.8 Вычисление
коэффициента вариации. Коэффициент вариации (CV) - относительный показатель,
выражающий изменчивость признаков в процентах:
![]()
При нормальном распределении
величина CV обычно не превышает 45-50%. В случаях асимметричных распределений
(например, по закону Пуассона) он может достигать 100% и выше. При определении
величины CV следует учитывать размерность признаков.
4.2.9 Вычисление
нормированного отклонения
Нормированное отклонение (t) показывает, на сколько сигм (σ) та или иная варианта или какой - либо член совокупности отклоняется от среднего уровня варьирующего признака:
![]()
Нормированное отклонение можно использовать для
сравнительной оценки индивидов контрольной и опытной групп по тому или иному
признаку.
4.3.
Использование пробит-анализа для определения ЛК50
При определении концентраций, способных вызывать
гибель 50% особей в выборке, проводят такое преобразование значений
концентрации и эффекта гибели организмов, при котором зависимость эффекта от
концентрации превращается из сигмоиды в прямую линию. Такое преобразование
позволяет по данным, полученным только для 3-4 концентраций, определить вероятный
эффект для всего диапазона концентраций от максимальной недействующей до
абсолютно летальной.
Для этого на графике значения процентных
концентраций вещества переводятся в логарифмическую форму, а полученный эффект
- из процентов гибели организмов в соответствующие им значения условных единиц
- пробитое. Значение пробитов приводятся в таблице 4.5
Таблица 4.5
Значение
процента гибели организмов в опыте соответствующему условному числу единиц -
пробитов
|
Гибель, % |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
|
2,67 |
2,95 |
3,12 |
3,25 |
3,35 |
3,45 |
3,52 |
3,59 |
3,66 |
|
10 |
3,72 |
3,77 |
3,82 |
3,83 |
3,92 |
3,96 |
4,01 |
4,05 |
4,08 |
4,12 |
|
20 |
4,16 |
4,19 |
4,23 |
4,26 |
4,29 |
4,33 |
4,36 |
4,39 |
4,42 |
4,45 |
|
30 |
4,48 |
4,50 |
4,53 |
4,56 |
4,59 |
4,61 |
4,64 |
4,67 |
4,69 |
4,72 |
|
40 |
4,75 |
4,77 |
4,80 |
4,82 |
4,85 |
4,87 |
4,90 |
4,92 |
4,95 |
4,97 |
|
50 |
5,00 |
5,03 |
5,05 |
5,08 |
5,10 |
5,13 |
5,15 |
5,18 |
5,20 |
5,23 |
|
60 |
5,25 |
5,28 |
5,31 |
5,33 |
5,36 |
5,39 |
5,41 |
5,44 |
5,47 |
5,50 |
|
70 |
5,52 |
5,55 |
5,58 |
5,61 |
5,64 |
5,67 |
5,71 |
5,74 |
5,77 |
5,81 |
|
80 |
5,84 |
5,88 |
5,92 |
5,95 |
5,99 |
6,04 |
6,08 |
6,13 |
6,18 |
6,23 |
|
90 |
6,28 |
6,34 |
6,41 |
6,48 |
6,55 |
6,64 |
6,75 |
6,89 |
7,05 |
7,33 |
На
графике, отражающем связь эффекта (в пробитах) с концентрацией (в логарифмах),
определяют точку, соответствующую пробиту 5 (50% гибели), и опускают из нее
перпендикуляр на ось концентраций. Основание этого перпендикуляра придется на
концентрацию, соответствующую ЛК50.
Помимо графического может быть использован расчетный
способ определения полуэффективной концентрации. Он основан на прямолинейной
зависимости эффекта от концентрации.
Зависимость между концентрацией и эффектом,
выраженным в пробитах, описывается следующим уравнением
у = Ао+А1х,
где у - значение зависимой переменной (признака),
х - значение признака или фактора,
А0 - начальное значение «у» при х = 0,
А1 - угловой коэффициент, характеризующий
зависимость «у» от «х» (тангенс угла наклона линии регресси к оси «у»).
Для вычисления коэффициентов Ао и А1
может быть использован калькулятор с программой определения коэффициентов прямолинейной
регрессии или производятся следующие операции.
По данным, полученным в испытаниях, составляется
таблица согласно форме 4.6
Таблица 4.6
Исходные данные для вычисления компонентов системы
уравнений при вычислении ЛК50 «методом наименьших квадратов»
|
Концентрация, мг/л |
х |
у |
В |
хВ |
х2В |
уВ |
хуВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Данные из таблицы используются для решения
следующей системы уравнений:
![]()
![]()
![]()
где x - порядковый номер
данной концентрации в шкале испытанных концентраций,
у - гибель тест - организмов, выраженная в пробитах,
В - весовой коэффициент пробита, определяемый по
таблице 4.7.
Таблица 4.7
Весовые
коэффициенты значений пробитов
|
Пробит |
0,0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
|
3 |
1,0 |
1,2 |
1,4 |
1,6 |
1,8 |
2,0 |
2,3 |
2,6 |
2,9 |
3,2 |
|
4 |
3,5 |
3,7 |
3,9 |
4,1 |
4,3 |
4,5 |
4,6 |
4,7 |
4,8 |
4,9 |
|
5 |
5,0 |
4,9 |
4,8 |
4,7 |
4,6 |
4,5 |
4,3 |
4,1 |
3,9 |
3,7 |
|
6 |
3,5 |
3,2 |
2,9 |
2,6 |
2,3 |
2,0 |
1,8 |
1,6 |
1,4 |
1,2 |
Из
уравнения (3) вычисляем А1 и подставляем его в уравнение (2) для
вычисления А0.
Подставив оба коэффициента и
величину «у», равную 5 (пробит 50%), в уравнение (1), можно вычислить искомую
величину концентрации ЛК50.
4.4.
Определение медианного летального времени
При определении медианного летального времени ЛВ50
регистрируется время наступления гибели каждой особи в исследуемых растворах в
острых опытах, составляющее от нескольких часов до суток и более (до конца
острого опыта). Затем строится график, где на одну из осей наносится время, на
другую - соответствующее количество живых особей. На одном графике можно
отобразить зависимости для нескольких концентраций и установить время гибели
50% особей. Затем строят график зависимости значений ЛВ50 от
концентрации изучаемого вещества. По этому графику устанавливают границы
перехода от остролетальных к хроническим летальным концентрациям.
Приложение А
ОСНОВНЫЕ
ПОНЯТИЯ
Биоактивация -
биотрансформация соединений с образованием более токсичных веществ [26].
Биодеструкция
(биодеградация) - свойство материалов или объектов изменять свою структуру
(качество) под влиянием биологических агентов [27].
Биологическое тестирование
(биотестирование) - оценка токсичности химических веществ и их смесей в воде (в
водной вытяжке ДО и других природных объектов и отходов производства) в
стандартных условиях по ответным реакциям водных организмов, являющихся
тест-объектами [ГОСТ
27065].
Биотест - совокупность
приемов получения информации о токсичности воды (донных отложений) для
гидробионтов на основе регистрации реакции тест-объекта [28].
Воспроизводимость результатов
биотестирования - характеристика качества биотестирования, отражающая близость результатов,
полученных по одной методике, на одном и том же эталонном веществе, но в
различных условиях (разными операторами, или в разных лабораториях, или в
разное время) [29].
Взвешенные вещества в природных
водах - частицы минерального и органического происхождения, которые по
размеру больше, чем коллоидные частицы, и находящиеся в воде во взвешенном
состоянии. Происхождение их различно: терригенное (продукты размыва почв,
горных пород), биогенное (фрагменты тел, экскременты организмов), вулканогенное
(обломочный материал вулканических извержений), хемогенное (продукты химических
реакций), космогенное (космическая пыль), антропогенное (поступающее со
сточными водами). Являются исходным материалом при образовании донных
отложений[30].
Водный объект -
сосредоточение вод на поверхности суши в формах ее рельефа либо в недрах,
имеющие границы, объем и черты водного режима [31].
Водоем - водный объект
в углублении суши, характеризующийся замедленным движением воды или полным его
отсутствием. Различают естественные водоемы, представляющие собой скопление
воды во впадинах, и искусственные водоемы - специально созданные скопления воды
в искусственных или естественных углублениях земной поверхности (ГОСТ 19179-73).
Гидробионты - водные
организмы.
Донные отложения (ДО) - донные
наносы и твердые частицы, образовавшиеся и осевшие на дно водного объекта в
результате внутриводоемных физико-химических и биохимических процессов,
происходящих с веществами как естественного, так и техногенного происхождения (ГОСТ
17.1.5.01-80).
Диапазон реагирования тест-объекта - интервал
концентраций, в котором находится средняя летальная или средняя эффективная
концентрация эталонного вещества [28].
Загрязнение водных объектов - сброс или
поступление иным способом в водные объекты, а также образование в них, вредных
веществ, которые ухудшают качество поверхностных и подземных вод, ограничивают
использование либо негативно влияют на состояние дна и берегов водных объектов
[31].
Исходный раствор -
концентрированный раствор исследуемого вещества, из которого готовят растворы с
разными концентрациями этого вещества.
Исходные ДО - донные
отложения с высоким содержанием исследуемого вещества, из которых путем разбавления
чистыми ДО готовят серию ДО с разными концентрациями данного вещества.
Индивидуальное вещество -химическое
соединение, полученное в результате конкретного химического процесса. Оно может
содержать примеси побочных продуктов химических реакций и продуктов
трансформации. Степень чистоты индивидуального вещества определяется
категориями: химически чистое (ХЧ), чистое для анализа (ЧДА), особо чистое (Ос.
Ч) и техническое [3].
Качество воды -
характеристика состава и свойств воды, определяющая пригодность ее для
конкретных видов водопользования (ГОСТ
17.1.1.01-77).
Концентрация средняя летальная (ЛК50)
- концентрация токсиканта в воде (ДО), вызывающая гибель 50% тест-объектов при
установленных условиях экспозиции в течение заданного срока наблюдений [28].
Концентрация средняя эффективная (ЭК50)
- концентрация токсиканта в воде (ДО), вызывающая изменение тест-реакции
тест-объектов на 50% при установленных условиях экспозиции в течение заданного
срока наблюдений [28].
Критерий токсичности - достоверное
количественное значение тест-параметра, на основании которого делают вывод о
токсичности объекта (воды, донных отложений, сточных вод, вещества и т.д.) [28].
Максимально допустимый уровень (МДУ) нормируемого
вещества в донных отложениях - количественная характеристика вещества в ДО,
определенная аналитическим путем, при которой хроническая токсичность ДО уже не
проявляется. Определятся для каждого тест-объекта по каждой тест-реакции.
Микрокосм - экспериментальная
экосистема, применяющаяся для изучения динамики токсического действия на водные
организмы и изменения в биоценозе под влиянием загрязнения [27].
Острое токсическое действие (острая
токсичность) - воздействие, вызывающее быструю ответную реакцию тест-объекта.
Острое токсическое действие чаще всего измеряют по тест-реакции «выживаемость»
за относительно короткое время (чаще всего 48-96 часов) при кратковременном
биотестировании [30].
Показатели токсичности - показатели,
на основании которых делают выводы о вредном действии вещества на жизненные
процессы водного организма. По отражению тех или иных сторон жизнедеятельности
показатели токсичности делят на биологические, морфологические,
физиологические, биохимические, биофизические, физико-химические и т.д. [28].
Поверхностные воды - воды,
находящиеся на поверхности суши в виде различных водных объектов (ГОСТ 19179).
Показатель жизнедеятельности
водного организма (в водной токсикологии) - морфологическая,
физиологическая, биохимическая или другая характеристика состояния водного
организма, которая используется для определения токсичности (вещества, воды,
донных отложении и др.).
Предельно допустимая концентрация вещества в воде (ПДК)
- концентрация вещества в воде, выше которой вода
непригодна для одного или нескольких видов водопользования (ГОСТ 2706-86).
Предельно допустимый уровень
вещества в донных отложениях (ПДУДО) -
экспериментально установленный показатель допустимого содержания вещества в
донных отложениях водного объекта, при котором вещество не переходит из твердой
части ДО и интерстициальной влаги в придонный слой воды в количестве,
превышающем ПДК нормируемого вещества в воде, и не вызывает гибели, нарушения
жизнедеятельности, отдаленных последствий на потомство организмов бентоса и
бентосоядных рыб, а также порчи товарных качеств промысловых гидробионтов при
непосредственном контакте с загрязненными ДО и через пищевые цепи.
Природные воды - воды Земли с
содержащимися в них твердыми, жидкими и газообразными веществами (ГОСТ 19179).
Природные смеси - совокупность
химических соединений, образующих природное тело, сформировавшееся в результате
естественных биогеохимических процессов, например нефть. Нефть - это сложная
природная смесь, состоящая, главным образом, из парафиновых, нафтеновых и
ароматических углеводородов (поликомпонентный раствор множества индивидуальных
соединений, представленных неполярными или весьма слабополярными молекулами,
которые заметно не растворяются в атмосферной воде) [30].
Принцип биотестирования при
установлении ПДУДО - установление отличий по
выживаемости и состоянию организмов в опытной среде («загрязненные донные
отложения - вода») по сравнению с контрольной средой («незагрязненные донные
отложения - вода») в течение экспозиции.
Принцип токсикометрии при
установлении ПДУДО - токсикологическое
исследование (биотестирование) донных отложений с внесенным в них химическим
веществом в широком диапазоне концентраций с целью выявления токсикологических
параметров и установления максимально допустимого уровня вещества в ДО.
Самоочищение воды - совокупность
природных процессов, направленных на восстановление экологического благополучия
водных объектов (ГОСТ
27065-86).
Сапробное загрязнение водоема - загрязнение
воды гниющей органикой.
Смесь - совокупность
любого количества индивидуальных веществ, содержащая их изначально (например,
нефть), или смешанных (например, буровые растворы) до поступления в окружающую
среду.
Тест-объект - организм,
который используют при биотестировании [5].
Тест-параметр -
количественное выражение тест-реакции. Например, процент снижения выживаемости,
плодовитости, ферментативной активности и т. д. тест-объектов в опыте по
сравнению с контролем [32].
Тест-реакция - изменение
выбранного показателя жизнедеятельности тест-объекта под действием токсиканта [32].
Токсичность воды (и донных
отложений) - свойство воды и донных отложений вызывать
нарушение жизнедеятельности или гибель водных организмов, обусловленное
присутствием токсических веществ [33].
Токсикант - вещество, способное
в определенной концентрации вызывать патологические изменения или гибель водных
организмов [27].
Токсический эффект - результат
воздействия токсиканта на водный организм, проявляющийся в изменении
показателей его жизнедеятельности или гибели [28].
Токсикорезистентность - способность
организма как можно дольше выживать при длительном воздействии малых
концентраций вещества или при краткосрочном действии больших концентраций этого
вещества [33].
Устойчивость гидробионтов к
токсикантам - эффективность компенсаторных реакций,
обеспечивающих поддержание гомеостаза и длительность выживания при
краткосрочном воздействии больших концентраций токсиканта (острое отравление)
или продолжительном воздействии малых концентраций токсиканта (хроническое
отравление). Показателями устойчивости могут быть либо выживание гидробионтов
(ВЛ50, ВЛ100) при заданной концентрации, либо
концентрация токсиканта (ЛК50 ЛК100), вызывающая гибель
при заданном времени наблюдении [34].
Хроническое токсическое действие (хроническая
токсичность) - воздействие, вызывающее ответные реакции тест-объекта, выходящие
за пределы нормы и проявляющиеся в течение относительного длительного периода
времени.
Чувствительность гидробионтов - это уровень
возбудимости, определяющий способность воспринимать минимальное воздействие
токсиканта и быстроту первичной реакции. Показателями чувствительности
гидробионтов к токсикантам являются латентный период (минимальное время)
проявления первичной реакции при заданной концентрации токсиканта или первичные
реакции на минимальную концентрацию токсиканта при заданном времени наблюдений
[34].
Эвтрофирующий эффект - результат
действия химических веществ (соли азота, фосфора, железа, кремния, некоторые
органические вещества) на сообщества водных организмов, проявляющийся в
чрезмерном повышении первичного продуцирования и последующим загрязнением
водных объектов органическим веществом.
Эталонное вещество - вещество с
известными токсическими свойствами, используемое для установления
метрологических характеристик методики биотестирования [29].
Приложение Б
УСТАНОВЛЕНИЕ
ХАРАКТЕРИСТИК ПОГРЕШНОСТИ МЕТОДИК БИОТЕСТИРОВАНИЯ
1. Характеристики погрешности методики
Границы интервала (Δ), в которых находится
погрешность методики с заданной доверительной вероятностью Р = 0,95 и
наибольшее возможное среднее квадратичное отклонение случайной погрешности
σ (Δ) (воспроизводимость), устанавливаются по результатам
внутрилабораторного эксперимента с использованием бихромата калия (K2Cr2O7).
Контроль воспроизводимости количественного
токсикологического анализа (КТА) в лаборатории проводят по результатам не менее
чем двух определений ЭК50 эталонного вещества (калия
двухромовокислого), полученных в условиях воспроизводимости (ЭК1, ЭK2).
Решение об удовлетворительности воспроизводимости
определений принимается при условии, что
(ЭК1 - ЭК2) ≤ Д,
где Д - норматив оперативного контроля
воспроизводимости,
Д = 2,77-d(Δ).
Ниже приводим известные характеристики погрешностей
методик биотестирования:
Photobacterium phosphoreum
|
ЭК50 мг/дм3 К2Сг2О7 (0,5 ч) |
δ (Δ) |
Δ |
||
|
мг/дм3 |
% |
мг/дм3 |
% |
|
|
0,85 |
0,18 |
22 |
0,35 |
41 |
Scenedesmus quadricauda
|
ЭК50 (96 ч) К2Сг2О7 мг/дм3 |
δ (Δ) |
Δ |
||
|
мг/дм3 |
% |
мг/дм3 |
% |
|
|
1,32 |
0,23 |
17 |
0,45 |
34 |
Tetrahymena pyriformis
|
ЭК50 () К2Сг2О7 мг/дм3 |
δ (Δ) |
Δ |
||
|
мг/дм3 |
% |
мг/дм3 |
% |
|
|
0,29 |
0,08 |
30 |
0,16 |
60 |
Daphnia magna
|
ЛК50 (96 ч) К2Сг2О7 мг/дм3 |
δ (Δ) |
Д |
||
|
мг/дм3 |
% |
мг/дм3 |
% |
|
|
1,1 |
0,37 |
34 |
0,73 |
66 |
Ceriodaphnia affinis
|
ЛК50 (96 ч) К2Сг2О7 мг/дм3 |
δ (Δ) |
Д |
||
|
мг/дм3 |
% |
мг/дм3 |
% |
|
|
1,08 |
0,33 |
31 |
0,65 |
61 |
Poecillia reticulata Peters
|
ЭК50 () К2Сг2О7 мг/дм3 |
δ (Δ) |
Δ |
||
|
мг/дм3 |
% |
мг/дм3 |
% |
|
|
48 |
15 |
20 |
15 |
30 |
3. Определение диапазона реагирования тест-организмов
на модельный токсикант
Ошибки в токсикологическом эксперименте должны быть
сведены к минимуму, для чего необходимо регулярно (не реже одного раза в три
месяца) контролировать толерантность используемых в лаборатории тест-организмов
к модельному «эталонному» токсиканту. В качестве модельного токсиканта для
определения устойчивости к нему гидробионтов используется калий
двухромовокислый K2Cr2О7, ГОСТ 4220-75.
Регулярно проводимая проверка позволяет выявить
ошибки при приготовлении исследуемых смесей и растворов, нарушения, допускаемые
в процессе культивирования организмов и условиях проведения опытов [29].
Если концентрация модельного токсиканта, вызвавшая
острую токсичность, не находится в интервале, который указан в методике,
следует проверить точность приготовления исследуемых растворов, условия
проведения опытов. Если ошибки при проведении опытов исключены, необходимо
сменить культуру тест-организмов, т.е. взять исходный материал в учреждениях,
где он имеется.
Диапазон реагирования тест-организмов на модельный
токсикант устанавливают в трех независимых опытах, проводимых в различных
условиях (в разное время или различными операторами) на нескольких растворах
различных концентраций модельного токсиканта признанного аналитического
качества или на стандартных образцах данного вещества, не менее чем в трех
повторностях для каждой концентрации. Испытания проводятся с соблюдением
требований, изложенных в соответствующих разделах данного руководства.
Исследования проводят с двухромовокислым калием в
качестве стандартного токсиканта. С этой целью на дистиллированной воде готовят
маточный раствор K2Cr2O7 с
концентрацией 1±0,01 мг/см3. Навеску 0,1 г K2Cr2O7
помещают в мерную колбу на 100 см3 и растворяют в небольшом
количестве дистиллированной воды, тщательно перемешивают и доводят до метки.
Затем готовят рабочий раствор модельного токсиканта 0,1±0,002мг/см3
разведением дистиллированной водой основного раствора в 10 раз. Для
приготовления экспериментальных растворов используют культивационную
(отстоянную питьевую или природную) воду.
Например, при испытании культуры дафний берут 1,8;
2,4; 3,4; 4,0 см3 рабочего раствора и доводят в мерной колбе
культивационной водой до 200 см3, что соответствует концентрациям
токсиканта 0,9; 1,2; 1,7; 2,0 мг/см3. В каждом из трех опытов в трех
повторностях определяют концентрацию двухромовокислого калия, вызывающую гибель
50% дафний за 24 ч эксперимента (ЛК5024ч).
Пример. В результате
трех опытов, выполненных в одной лаборатории одним оператором в разные дни,
установлены следующие ЛK5024 - 1,5; 1,3 и 1,6 мг/дм3,
средняя концентрация 1,5 мг/дм3 укладывается в установленный
диапазон 0,9-2,5 мг/дм3.
Следовательно, культура
дафний, используемая в испытаниях, удовлетворяет требованиям реагирования на
модельный токсикант.
Установление метрологических характеристик
погрешности методик биотестирования в условиях межлабораторного эксперимента
производится в соответствии с [5].
Приложение В
Таблица 1
Апробированные
тест-системы, рекомендуемые для биотестирования донных отложений
(дополнительный список)
|
Критерий |
Экологические значение |
Толерантность к физико-химическим характеристикам
грунта |
Чувствительность к токсикантам |
Непосредственный контакт с грунтом |
Лабораторная культура |
Показатели (экспозиция, сут.) |
Литературный источник |
|
Тест-организмы |
|||||||
|
Насекомые |
|
|
|
|
|
выживаемость, |
[36] |
|
Chironomus |
|
|
|
|
|
рост(10), |
|
|
riparius |
+ |
+ |
+ |
+ |
+ |
выживаемость, |
|
|
|
|
|
|
|
|
вылет (28), |
|
|
Chironomus |
|
|
|
|
|
выживаемость, |
[37] |
|
tentans |
+ |
+ |
++ |
+ |
+ |
рост(10) |
|
|
Олигохеты |
|
|
|
|
|
выживаемость, |
|
|
Tubifex tubifex |
+ |
+ |
++ |
+ |
+ |
репродукция (28), |
[38] |
|
|
|
|
|
|
|
выживаемость, |
|
|
Lumbriculus |
+ |
+ |
+ |
+ |
+ |
рост (10), |
[39] |
|
variegatus |
|
|
|
|
|
выживаемость, |
|
|
|
|
|
|
|
|
репродукция (28) |
|
|
Ракообразные |
|
|
|
|
|
|
[40] |
|
Амфиподы |
|
|
|
|
|
выживаемость, |
|
|
Gammarus sp. |
|
|
|
|
|
(28-56) |
|
|
Gmelinoides |
|
|
|
|
|
|
|
|
fаsciatus |
+ |
+ |
+ |
+ |
+ |
|
|
|
Ветвистоусые
ракообразные |
|
|
|
|
|
|
|
|
Ceriodaphnia |
|
|
|
|
|
|
[41] |
|
affinis, |
+ |
+ |
+ |
н/о |
+ |
|
|
|
Eurycercus |
+ |
+ |
+ |
+ |
+ |
выживаемость, |
|
|
lamellatus |
|
|
|
|
|
репродукция (7) |
|
|
Моллюски |
|
|
|
|
|
|
|
|
Sphaerium sp. |
+ |
+ |
+ |
+ |
+ |
|
[42] |
|
Planorbis
sp. |
+ |
+ |
+ |
+ |
+ |
|
|
|
Physa
sp. |
+ |
+ |
+ |
+ |
+ |
выживаемость (10) |
|
|
Рыбы |
|
|
|
|
|
выживаемость, |
[43] |
|
Pimephales |
+ |
+ |
+ |
н/о |
+ |
рост, |
|
|
promelas |
|
|
|
|
|
репродукция (7-21) |
|
Таблица 2
Тест-система для выявления различных генетических повреждений (на
основе модельной системы)
|
Группа, трофический уровень, лит. источник |
Организмы |
Храмосомные aбeppации |
Генные мутации |
Дифференциальная активность генов |
|
Бактерии /редуцеты/ [44] |
Escherichia coli |
- |
+ |
- |
|
Salmonella
tiphimurium. |
- |
+ |
|
|
|
Bacillus subtilis |
- |
+ |
|
|
|
Водоросли, макрофиты /продуценты/ [45] |
Scenedesmus
quadricauda Breb. |
Выявляются морфогенетические мутации после 24 часовой экспозиции в токсиканте и переводе культуры на чистую среду |
||
|
+ |
- |
- |
||
|
Ракообразные /консументы 1-го порядка/[46] |
Дафнии Daphnia magna |
Выявляются морфогенетические мутации после 48 часовой экспозиции в токсиканте, и перемещении в чистую воду. На трех последующих поколениях. |
||
|
Годовики радужной форели |
+ |
- |
+ |
|
|
Рыбы, нектон /консументы 2-го и 3-го порядка/ [47] |
Осетровые, сиговые, карповые |
Выявляются хромосомные аберрации на эпителии хрусталика рыб |
||
|
+ |
+ |
- |
||
|
Аквариумные рыбки |
На эмбрионах рыб, на хромосомах, в глазных пузырях, эпидермис личинок рыб |
|||
|
Данио рерио, сомики, гуппи |
+ |
+ |
- |
|
Приложение
Г
ПЕРЕЧЕНЬ
ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
1. Федеральный закон «Об
охране окружающей среды» от 10 января 2002 г. № 7-ФЗ.
2. Методические рекомендации
по установлению предельно допустимых концентраций загрязняющих веществ для
рыбохозяйственных водоемов. - М.: ВНИРО, 1986. - 87 с.
3. Методические указания по
установлению эколого-рыбохозяйственных нормативов (ПДК и ОБУВ) загрязняющих
веществ для воды водных объектов, имеющих рыбохозяйственное значение / Под ред.
О.Ф. Филенко, С.А. Соколовой. - М.: ВНИРО, 1998. - 145 с.
4. Методические указания по
установлению ПДК вредных веществ для воды и рыбохозяйственных водоемов и
дополнительных характеристик, нужных для расчета ПДС. - Л.: ГосНИОРХ, 1989. -
51 с.
5. Руководство по
определению методом биотестирования токсичности вод, донных отложений,
загрязняющих веществ и буровых растворов. Министерство природных ресурсов
Российской Федерации, РЕФИА, НИА-Природа, М., 2002, 117 с.
6. Порядок организации
разработки и утверждения ПДК и ОБУВ загрязняющих веществ в воде
рыбохозяйственных водных объектов. Утв. Госкомрыболовства России 14.09.95. №
12-04-11/454, зарегистрировано Минюстом 06.12.95 № 987
7. Руководящий документ «О
порядке аттестации научно-исследовательских институтов, лабораторий и других
специализированных организаций, занимающихся разработкой ПДК и ОБУВ
загрязняющих веществ для воды рыбохозяйственных водоемов». Утв.
Госкомрыболовства России 20.09.95 № 12-04-11/486, зарегистрирован Минюстом
России 06.12.95 № 987.
8. Нормативное обеспечение
контроля качества воды. Справочник. - М.: Госстандарт России, 1995.
9. Мейнелл Д., Мейнелл Э.
Экспериментальная микробиология. - М., 1967. - 347 с.
10. Романенко И.И., Кузнецов
С.И. Экология микроорганизмов пресных водоемов. - Лабораторное руководство. -
Л., 1974. - 194 с.
11. Строганов Н.С. Методика
определения токсичности водной среды. - В сб. Методики биологических
исследований по водной токсикологии. - М.: Наука, 1971. - с. 14-60.
12.
Nebeker a.v., Miller G.F. use of
the amphipod crustacean Hyalella azteca in freshwater and estuarine sediment
toxicity test // Environ. Toxcol. Chem. 1988. V.7, pp. 1027-1033.
13. Лукянова О.Н.
Молекулярные биомаркеры. - Владивосток: ДВГАЭУ, 2001 - 196 с.
14 Методика
морфо-физиологических и биохимических исследований рыб. - М., 1972. - 92 с.
15. Михайлова Л.В. Действие
водорастворимой фракции усть-балыкской нефти на ранний онтогенез стерляди //
Гидробиологический журнал. - 1991. Т. 27, № 3. - С. 77 - 86.
16. Решетников Ю.С., Мухачев
И.С., Болотова Н.Л. и др. Coregonus peled (Gmelin, 1788): Систематика,
морфология, экология, продуктивность. - М.: Наука, 1989. - 303с.
17. Временные методические
рекомендации по установлению эколого-рыбохозяйственных нормативов загрязняющих
веществ для морских вод. - М.: ВНИРО, 1999. - 76 с.
18. Детлаф Т.А., Гинзбург
А.С., Шмальгаузен И.И. Развитие осетровых рыб. - М.: Наука, 1981. - 224 с.
19. Макгрегор Г., Варли Дж.
Методы работы с хромосомами животных. - М.: Мир, 1986. - 272 с.
20. Объекты биологии
развития. - М.: Наука, 1975. - 579 с.
21. Тахтаджян А.А., Федоров
А.А., Буданцев А.А. и др. Жизнь растений. Т. 5. Цветковые растения:. - М.:
Просвещение, 1982. - 520 с.
22. Мережко Ю.А., Якубовский
О.Г. Высшая водная растительность как фактор, предотвращающий загрязнение
водоемов поверхностных стоков // Формирование и контроль качества поверхностных
вод. - Киев: Наукова думка, 1976. - № 3. - С. 34 - 38.
23. Плохинский Н.А.
Биометрия. - Новосибирск: Изд-во СО АН СССР, 1961.
24. Лакин Г.Ф. Биометрия. -
М.: Высшая школа, 1973. - 344 с.
25. Терентьев П.В., Ростова
Н.С. Практикум по биометрии. - Л.: Изд-во ЛГУ, 1977. - 152 с.
26. Филенко О.Ф. Водная
токсикология. - Черноголовка, 1988. - 155 с.
27. Реймерс Н.Ф.
Природопользование. - М.: Мысль, 1990. - С44.
28. Строганов Н.С. Краткий
словарь терминов по водной токсикологии. - Ярославль: Изд. Ярославского ГУ,
1982. - С 42
29. Жмур Н.С.
Государственный и производственный контроль токсичности вод методами биотестирования
в России. - М.: Международный Дом Сотрудничества, 1997. - 115 с.
31. Методы токсикологической
оценки загрязнения пресноводных экосистем. - М.: АСН Госкомгидромета, 1994. -
130 с.
32. Водный кодекс Российской
Федерации от 16 ноября 1995. № 167-ФЗ.
33. Химический
энциклопедический словарь / Под ред. И.Л. Кнунянц.- М.: Советская энциклопедия,
1983. - 791 с.
34. РД 118.02 - 90
Методическое руководство по биотестированию воды.
35. Первый симпозиум по
чувствительности и устойчивости гидробионтов к токсикантам: Решение. - М.,
1985. - 4 с.
36.
WestC.W., Matsson V.R., Leonard E.N., Phipps G.L., Ankley G.T. Comparison of
the relative sensitivity of three benthic invertebrates to copper- contaminated
sediments from the Keweenaw Waterway// Hydrobiologia. 1993.N 262, pp. 57-63.
37.
Burton G.A.Jr. Assessment of freshwater sediment toxicity // Environ. Toxicol.
Chem. 1991. Vol. 10, pp. 1585-1627.
38.
Reynoldson T.B. Interactions between sediment contaminants and benthic
organisms // Hydrobiologia. 1987. V. 149, pp. 53-66.
39.
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D., Ankley G.T. The hydependent
toxicity of Cd, Cu, Ni, Pb and Zn tj Ceriodaphnia dubia, pimephales promelas,
Hyalella azteca and Lumbriculus variegates // Environm. Toxicol. Chem. 1993, v.
12, pp. 1263-1266.
40.
Roddie В., Edwards Т., Crane M. Potential impact of watercress farm
discharges of the freshwater amphipod Gammarus pulex// Bull. of Environ.
Contam. and Toxicol 1992. V. 48, pp. 63-69.
41.
Roddie В., Edwards Т., Crane M. Potential impact of watercress farm
discharges of the freshwater amphipod Gammarus pulex// Bull. of Environ.
Contam. and Toxicol 1992. V. 48, pp. 63-69.
42.
Crene M., Fleming R., Byron N., van de Guchte K, et. al. Sediment Tests for
Poorly Water-soluble Substances/ Report to the European Commission. 1993.
43.
Prater B.I., Anderson M.A. A 96-hour bioassay of Otter Creek, Ohio // J. Water
Pollut. Control Fed. 1977. V. 49, pp. 2099-2106.
44. Айальф Крайгер Дж.
Современная генетика. - М.: Мир, 1987. - Т.1. - 295С.
45.
Drake J.W. et. all. Environmental Mutagenis Hazarbs. Science, v. 187-1975. - P.
503-514.
46. Симаков Ю.Г. и др.
Биотестирование токсичности соединений в водной среде на политенных хромосомах
хирономид. - Тез. докл. Первой Всесоюзной конференции по рыбохозяйственной
токсикологии. - Рига, 1989. - с.120.
47. Симаков Ю.Г. Методы
оценки мутагенной и митогенной активности веществ в подострых опытах на
эпителии хрусталика глаза рыб. //Тез. докл. Методы ихтиотоксикологических
исследований. - Л: НПО Промрыбзавод, 1987. - С. 130.